da Leadership Medica n. 9 del 2002
 Di tutte le malattie che hanno accompagnato fin dai primordi l’umanità, fra peste, colera, vaiolo e tubercolosi, senza dubbio la lebbra è quella che ha lasciato la traccia più profonda, purtroppo visibile ancor oggi, tanto visibile e sentita e così terribile anche nel nome, che da una ventina d’anni s’è pensato di cambiarne il nome in morbo di Hansen, con la speranza, forse di rendere più sopportabile il disagio a chi oggi ne risultasse affetto.
Di tutte le malattie che hanno accompagnato fin dai primordi l’umanità, fra peste, colera, vaiolo e tubercolosi, senza dubbio la lebbra è quella che ha lasciato la traccia più profonda, purtroppo visibile ancor oggi, tanto visibile e sentita e così terribile anche nel nome, che da una ventina d’anni s’è pensato di cambiarne il nome in morbo di Hansen, con la speranza, forse di rendere più sopportabile il disagio a chi oggi ne risultasse affetto.
Cerchiamo quindi in breve di capire come e perché questo sia avvenuto. Si discute ancora dagli studiosi di paleopatologia se la parola egiziana ukede, quella ebraica zaraath, quella indiana kustha, quella cinese da feng, significassero Lebbra o altre malattie o un insieme di malattie. Nel Susruta Samita (libro indiano del VI a.C.) si parla anche della cura con un olio estratto dalla pianta del Hydnocarpus Wigtiana, olio di chaulmoogra, sostanza che è stata utilmente usata fino agli anni 40!
Il mondo greco romano non ebbe molta dimestichezza con la malattia, indicava con la parola lepra ed elefantiasi forse altre malattie cutanee e la leggenda racconta che lo stesso imperatore Costantino ne fosse stato guarito con il battesimo, ma più probabilmente con questo caso la parola L. vuole indicare una tara morale più che l’affezione vera e propria.

Con Alessandro Il Grande nel III sec. a.C., di ritorno dall’India e con Pompeo Magno nel 62 dall’Egitto la L. prese piede in Grecia prima ed in Italia dopo ed è proprio in quel periodo che si hanno le prime descrizioni cliniche (Areteo di Cappadocia). Ma furono le Crociate, quello strano fenomeno religioso-politico-militare a diffondere capillarmente in Europa la malattia che divenne in pochi anni terribile pandemia; fu difatti proprio in quel periodo che nacque il mito orribile della lebbra e del lebbroso come persona colpita da maledizione che bisognava tenere lontano dalla comunità: tu sei morto al mondo, ormai, riponi la tua speranza in Dio!! Era questa la formula canonica con cui il malato veniva ufficialmente dato per morto per la società, espulso dalla città, costretto ad indossare il vestito del lebbroso con un campanello che ne rivelava la presenza e mettere in guardia le persone al suo passaggio. In alcune città come Vicenza un regolamento del 1300 dava preciso incarico a sorveglianti di scacciare fuori delle mura chi fosse stato dichiarato ammalato da commissioni formate da medici, ecclesiastici e perfino da ammalati (probabilmente) guariti.

In alcuni casi le misure furono assai più disumane, soprattutto per la ragione che indicava i lebbrosi come nemici dell’umanità, alleati del demonio, autori e portatori di sciagure come quando in Francia, in seguito alla peste del 1312 ed in ossequio di Filippo V, nella città di Limoges, in un mese ne furono bruciati vivi 45! La pratica dell’isolamento in lazzaretti o lebbrosari nacque dunque in quel periodo: non esisteva città, paese o borgata che non ne avesse almeno uno e secondo Mézeray in Europa ne esistevano 19.000, in Italia settentrionale 33. La terribile epidemia cominciò a regredire verso la metà del XIV secolo fino a scomparire nel 1700 nell’Europa centrale ed occidentale.
Le ragioni del declino furono diverse: tra le più credibili possiamo elencare:
1. isolamento dei malati;
2. mortalità più elevata tra gli affetti tra le frequenti epidemie di peste, colera ,vaiolo;
3. miglioramento delle condizioni igieniche;
4. antagonismo fra tbc e lebbra;
5. resistenza immunologica acquisita poco alla volta. Focolai endemici persistettero solo in Spagna, Italia, Grecia, Russia meridionale e Scandinavia, mentre bisogna dar atto alla Norvegia di aver affrontato verso il 1850 l’argomento in maniera razionale e decisa quando aveva 5.000 affetti: in 70 anni passò da un’incidenza del 10/50 per 100.000 abitanti, alla completa scomparsa attuando rigidamente l’internamento e l’isolamento.
Ma intanto quasi tutti in continenti erano stati invasi.
L’America dagli spagnoli prima e dagli schiavi negri poi, in Oceania all’epoca delle scoperte geografiche, in Cina, uno dei più antichi focolai conosciuti, una precisa descrizione la dà Sung Szumoth, morto nel 682 chiamandola thai feng. Dalla Cina sconfina in Giappone, nel Vietnam e via via in tutto il sud-est asiatico. All’inizio dell’800 guadagna le isole del Pacifico e così in forma epidemica si spande nelle Hawaii, in Nuova Caledonia e nell’isola di Nauru (1912) dove ne fu studiata attentamente l’epidemiologia in quanto dodici anni dopo la comparsa del primo caso, il 24% degli abitanti ne restò contagiato.


Dalle nebbie medioevali a metà 800, in uno dei momenti più esaltanti della storia della medicina, anche la L. trova i suoi appassionati ricercatori e così nel:
- 1847 i dermatologi norvegesi Danielsen e Boeck descrivono su Om Spedalsked la lebbra tuberosa;
- 1863 Virchow descrive l’istopatologia della L. lepromatosa;
- 1873 Armauer Hansen, norvegese, identifica il mycobatterio come responsabile dell’affezione;
- 1919 Mitsuda, giapponese, descrive la reazione alla lepromina;
- 1941 Faget, a Carlville (Louisiana-USA), usa la promina, derivato del diaminodifenilsulfone e pubblica i risultati nel 1943, confermandoli nel 1946. Occore però ricordare che il d.d.s. era stato sintetizzato già dal 1908 dai tedeschi Fromm e Wittmann;
- 1960 Shepard inocula il bacillo nel cuscinetto plantare del topo;
- 1964 primo allarme di Pettit e Rees sui primi casi di resistenza al dapsone;
- 1969 i primi studi sull’attività battericida della rifampicina furono compiuti al Centro hanseniano di Gioia del Colle (Ba), confermati da Rees e coll. e Leiker nel 1970;
- 1971 Kircheimer e Storrs pubblicano le esperienze sull’inoculazione nell’armadillo a nove bande. Questo fa sperare di aver a disposizione grandi quantità di materiale bacillare per la preparazione di un vaccino, speranza andata poi delusa;
- 1981 Un gruppo di studiosi dell’OMS raccomanda nella lotta contro la L., diventata ormai un obiettivo primario della sanità mondiale, l’uso della polichemioterapia.
 Ma nonostante questi 150 anni di studi, ricerche, programmi di risanamento e grosse cifre impegnate dall’OMS, ad oggi la L. non mostra di cedere il passo. Vero è che, specie in Africa fin dalla metà dell’800, le allora cosiddette potenze coloniali avevano messo in piedi, poco alla volta nei proprio territori, direttamente o tramite le tante associazioni filantropiche, tutte le misure sanitarie del tempo con la costruzione di villaggi, ospedali, dispensari per la lotta contro le malattie più diffuse (malaria, TBC, febbre gialla, vaiolo e lebbra) ma la ventata decolonizzatrice degli anni 60 e 70 in qualche anno ha fatto regredire quanto era stato creato in 100 anni.
Ma nonostante questi 150 anni di studi, ricerche, programmi di risanamento e grosse cifre impegnate dall’OMS, ad oggi la L. non mostra di cedere il passo. Vero è che, specie in Africa fin dalla metà dell’800, le allora cosiddette potenze coloniali avevano messo in piedi, poco alla volta nei proprio territori, direttamente o tramite le tante associazioni filantropiche, tutte le misure sanitarie del tempo con la costruzione di villaggi, ospedali, dispensari per la lotta contro le malattie più diffuse (malaria, TBC, febbre gialla, vaiolo e lebbra) ma la ventata decolonizzatrice degli anni 60 e 70 in qualche anno ha fatto regredire quanto era stato creato in 100 anni.
Se pensiamo ai 20 milioni di vittime dell’AIDS di oggi, abbiamo il quadro mortificante di un continente in agonia.
Eziopatogenesi
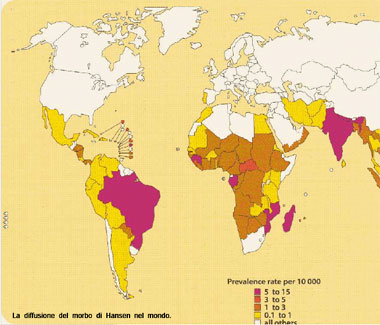
Fare una stima degli affetti da L. oggi nel mondo non è possibile: al minimo due milioni, qualcuno si spinge fino a dieci, ma continuamente ci si chiede come mai ancor oggi in piena era antibiotica questo sia possibile, per cui è bene chiarire le ragioni in maniera molto sintetica:
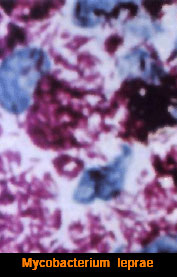
- il primo motivo sta nel fatto che ancor oggi, contrariamente a tutti gli altri microrganismi, il bacillo di Hansen non è coltivabile;
- la L. è una patologia esclusivamente umana, non è stato possibile trasferire la patogenicità del my. su animali, nemmeno su quelli geneticamente più affini all’uomo;
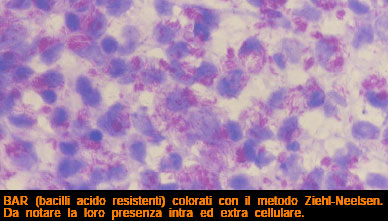
- la particolare struttura della parete cellulare del mycobatterio, nonostante la sua capacità antigenica, esplica la fondamentale funzione protettiva mediante i glicolipidi escreti dal bacillo che lo rendono intaccabile all’attività litica dei fagociti, sicché il mycobatterio riesce a sopravvivere ed a moltiplicarsi in numero enorme nel citoplasma dei macrofagi.

È stato calcolato che nei casi di L. L. possono svilupparsi fino a 7 miliardi di mycobatteri per grammo di tessuto. Questa enorme quantità di germi spiega la possibilità del contagio inter-umano. Anche su questo argomento si discute ancora: superata da tempo l’idea che la L. sia una malattia congenita, il bacillo dunque ha due possibilità d’ingresso in un organismo sano, il primo “da pelle a pelle” tramite lesioni cutanee , l’altra molto più insidiosa attraverso la mucosa delle vie respiratorie analogamente a quello della tubercolosi.
 Qualunque sia la porta d’ingresso, il mycobatterio viene inglobato dai macrofagi che nella maggior parte dei casi riescono a neutralizzarlo ed a isolarlo ma nei casi in cui il processo di degradazione del corpo bacillare non avviene, dovuto forse all’inibizione dei processi di produzione dei derivati attivi dell’ossigeno o del monossido di azoto etc., il fagocita che è una cellula mobile, si comporta esattamente come il cavallo di Troia, cioè dà il tempo al mycobatterio di organizzarsi e moltiplicarsi nel suo interno e quasi in simbiosi, in quei tessuti dove trova il suo optimum per il suo sviluppo e cioè nelle guaine dei grossi nervi periferici e nello spessore cutaneo.
Qualunque sia la porta d’ingresso, il mycobatterio viene inglobato dai macrofagi che nella maggior parte dei casi riescono a neutralizzarlo ed a isolarlo ma nei casi in cui il processo di degradazione del corpo bacillare non avviene, dovuto forse all’inibizione dei processi di produzione dei derivati attivi dell’ossigeno o del monossido di azoto etc., il fagocita che è una cellula mobile, si comporta esattamente come il cavallo di Troia, cioè dà il tempo al mycobatterio di organizzarsi e moltiplicarsi nel suo interno e quasi in simbiosi, in quei tessuti dove trova il suo optimum per il suo sviluppo e cioè nelle guaine dei grossi nervi periferici e nello spessore cutaneo.
Si spiega così quel lungo periodo di latenza clinica che va dal momento in cui il bacillo è entrato nell’organismo ospite a quello dei primi segni clinici della malattia, periodo che può durare anche più di 10 anni. Dimostrativo il caso di due marinai americani che durante la seconda guerra mondiale si fecero tatuare in Australia su un braccio: solo dopo 2 anni e mezzo svilupparono una lesione leprosa sul punto del tatuaggio.
Classificazione e forme cliniche
Non esiste altra malattia cronica che, come la L. venga distinta in tante varianti cliniche a cui corrispondono altrettanti aspetti istopatologici che sono a loro volta espressione della risposta immunitaria del paziente.
Dalle definizioni di L. tuberosa, ulcerativa, anestetica, mutilante, nervosa, maculare dei primi leprologi, si è passati via via all’attuale, proposta da Ridley e Jopling che distinguono:
- una forma indeterminata (L. I.) spesso iniziale;
- due forme polari: tubercoliode (T. T.) a forte impegno immunitario e la lepromatosa (L. L.) a risposta immunitaria debole o negativa;
- altre forme interpolari dette borderline (B. T., B. B., B. L.) a risposta variabile ed instabile.
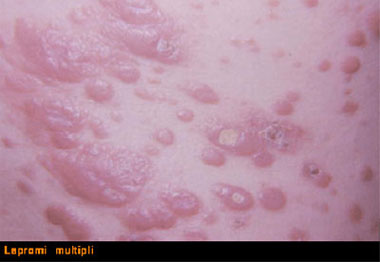
Di fronte a questo straordinario polimorfismo, la diagnosi di morbo di Hansen è spesso difficile anche per medici esperti, giacché l’esordio clinico è quanto mai vario: da piccole zone di ipoestesia cutanea, a chiazze ipocromiche o leggermente eritematose più o meno estese, a lesioni papulose o francamente nodulari, che nella maggioranza dei casi trattate con le terapie più varie, fanno perdere la essenzialità del significato morfologico della lesione e quindi la vera diagnosi differita spesso di qualche anno, quando l’invasione bacillare ha prodotto i suoi danni negli apparati più sensibili ed irrecuperabili come quelli nervosi, oculari, osteo-articolari.
La Neuropatia Leprosa
Si instaura molto insidiosamente: quasi mai dolorosa, si rivela in occasioni di ustioni che fanno prendere coscienza di una analgesia patologica. Generalmente è persa prima la sensibilità termo-dolorifica con la conservazione della tattile, spesso associata ad altre manifestazioni, quali l’anidrosi, l’alopecia e l’ariflessia vasomotrice generalmente nelle regioni distali degli arti. Altro sintomo presente in circa il 30% dei pazienti è l’ispessimento alla palpazione dei tronchi nervosi, quasi sempre cilindrico nel loro decorso, più raramente nodulare e può interessare il plesso cervicale superiore, la branca sovra-orbitaria del trigemino, il radiale, il peroneo comune, il surale ed il tibiale posteriore.

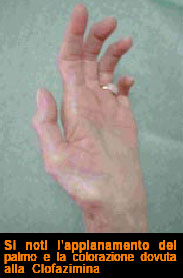
Particolare attenzione va posta ai nervi ulnare e mediano che sono nervi misti (sensitivi e motori), il cui interessamento porta ad una delle condizioni più invalidanti della malattia: la mano ad artiglio. La perdita di sensibilità nella zona ulnare e radiale e successivamente per la paresi o paralisi dei muscoli lombricali ed interossei, di quelli dell’eminenza tenar ed ipotenar, la mano diventa piatta con la perdita di quel gesto che distingue la specie umana e cioè la capacità dell’adduzione e dell’opposizione del pollice con le altre dita. Analoghe lesioni compaiono ai piedi per interessamento dei nervi che sovrintendono alle funzioni motorie, sensitive e vegetative, per cui il piede diventa anidrotico, perde la sensibilità termo-tattile-dolorifica con la progressiva atrofia dei muscoli intrinseci ed estrinseci che portano alla scheletrizzazione del piede e ben presto alla formazione dell’ulcera plantare che rappresenta una delle afflizioni più sentite dal paziente.
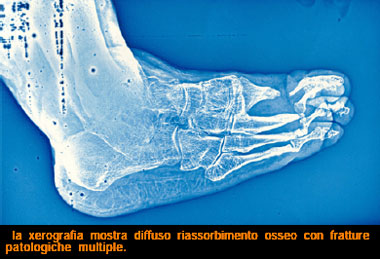
Frequenti i riassorbimenti ossei con osteolisi spontanee. In una variante clinica molto rara, la c.d. lebbra neuritica pura, in assoluta assenza di manifestazioni cutanee, il my. è reperibile solo nelle guaine nervose periferiche e va ricercato appunto nelle strutture perineurali attraverso una breccia cutanea.
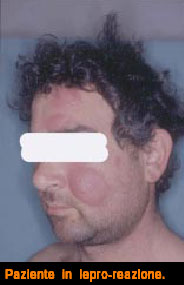
La Leproreazione
Se le lesioni nervose stabilizzate prima o poi procurano invalidità permanente, ma instaurandosi lentamente danno il tempo al paziente di adattarsi e trovare atteggiamenti e movimenti alternativi per gli atti normali di vita, c’è un momento nella vita dell’hanseniano che rappresenta un momento drammatico della sua esistenza.
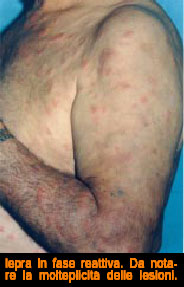
Questo momento è la temuta leproreazione. Dai registri storici del nostro ospedale abbiamo calcolato che negli anni 1928/1950, cioè prima dell’era cortisonica, l’exitus dei pazienti in questa fase raggiungeva il 10% e si verificava puntualmente nel periodo primaverile ed autunnale. Clinicamente si presenta con improvvisa sensazione di malessere, febbre, algie diffuse, profonda astenia. Sulla cute compaiono lesioni eritematose violacee, rilevate, dolenti che nelle forme severe tendono all’ulcerazione. Importante è la partecipazione di altri organi come l’occhio, il rene, l’epididimo. I parametri ematochimici evidenziano marcata proteinuria, intensa leucocitosi, VES alta, ipergammaglobulinemia alfa2, PCR, iperfibrinemia, ipocomplementemia, presenza di complessi immuno-circolanti.
Le cause scatenanti non sono state ancora chiarite, ma certamente sono molteplici, tra le più probabili la reazione ad antigeni mycobatterici o sensibilizzazione ad antigeni di altri germi cross-reagenti. La fenomenologia reattiva così brevemente descritta, ma molto impegnativa per il medico, può durare mesi o anni con fasi acute ed apparenti remissioni, ma che alla fine lasciano il segno del suo passaggio negli organi ed apparati più sensibili a queste tempeste immunologiche come l’occhio, il rene ed i nervi periferici.
L’uso del prednisone, della talidomide e di altri immunosoppressori usati con criterio ed esperienza riducono generalmente il danno.
Terapia
La cura della L. è condizionata oggi da molteplici fattori:
- l’impossibilità di un antibiogramma per l’impossibilità culturale del my;
- il riscontro sempre più frequente di ceppi resistenti;
- la necessità di estendere la cura a milioni di persone che vivono nei paesi più poveri del mondo, senza attrezzature, dispensari e personale qualificato.
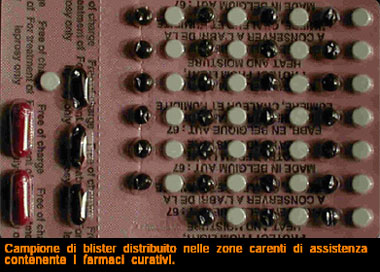
Per questa ragione dal 1981 l’OMS ha raccomandato l’uso della polichemioterapia che consiste nella somministrazione contemporanea dei farmaci attualmente più attivi.
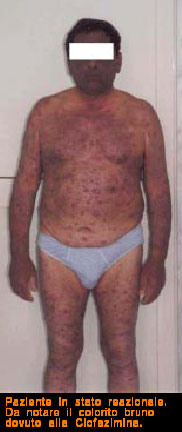
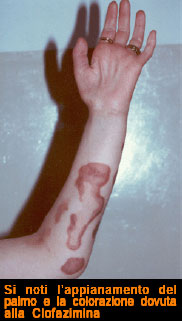
Primo tra tutti la Rifampicina, battericida al 99% sui bacilli sensibili, la Clofazimina che ha sicuramente azione batteriostatica ed antinfiammatoria, ma ha la caratteristica di colorare la cute bianca di un colorito bruno scuro.
 Il Diaminodifenilsulfone (d.d.s.) che ha azione batteriostatica, in genere ben tollerato, ma qualche volta specie in pazienti con deficit di glucosio-6-fosfato deidrogenasi, può provocare crisi emolitiche. Il dosaggio di questi farmaci che dovrebbero agire in sinergia, raccomandato dall’OMS è di 600 mg di Rifampicina una volta al mese, Clofazimina 300 mg una volta al mese più 50 mg quotidiani e d.d.s. 100 mg al dì. Naturalmente i dosaggi e i singoli farmaci vanno personalizzati a seconda della tolleranza individuale e fino alla negativizzazione, cioè alla scomparsa dei bacilli dal muco nasale e dalle lesioni cutanee. La OMS e le tante Associazioni filantropiche che agiscono in tutto il mondo nella lotta contro la L. hanno confezionato dei pratici blisters che contengono i 3 farmaci con l’indicazione dell’uso. Questo presidio è distribuito per lo più nelle tante zone carenti di assistenza. La Lebbra oggi nel mondo Nel Congresso Mondiale del 1986 a L’Aja, il responsabile per la L. dell’OMS dott. Nordeen, incoraggiato forse dal buon andamento della campagna mondiale contro la poliomielite, annunciò che l’OMS si era dato un termine per l’eradicazione della L. nel mondo: il termine era l’anno 2000, ma le condizioni d’instabilità politica di tanti Stati o di interi continenti come l’Africa, il nuovo flagello dell’AIDS, non hanno permesso il mantenimento dell’impegno. Riporto senza commenti i dati riguardanti i nuovi casi di contagio in alcuni paesi nel 2000: India 495.000 Brasile 78.100 Mozambico 28.500 Indonesia 23.200 Riguardo al nostro Paese si può affermare che la vecchia epidemia è finalmente conclusa, i secolari focolai calabresi, liguri, pugliesi, si sono esauriti, rimangono in costante osservazione circa 400 pazienti con 3-4 nuovi casi l’anno di italiani residenti; il temuto aumento dovuto agli immigrati è stato contenuto grazie al lavoro svolto negli ultimi 20 anni dai 4 Centri Italiani (Genova, Messina, Cagliari, Gioia del Colle), non solo sotto il profilo diagnostico e terapeutico, ma anche per il lavoro di ricostruzione di vecchie lesioni grazie alle nuove tecniche chirurgiche e fisioterapiche. Tuttavia continua ad essere necessario un attento monitoraggio, soprattutto nei centri di accoglienza degli immigrati provenienti da paesi a rischio.
Il Diaminodifenilsulfone (d.d.s.) che ha azione batteriostatica, in genere ben tollerato, ma qualche volta specie in pazienti con deficit di glucosio-6-fosfato deidrogenasi, può provocare crisi emolitiche. Il dosaggio di questi farmaci che dovrebbero agire in sinergia, raccomandato dall’OMS è di 600 mg di Rifampicina una volta al mese, Clofazimina 300 mg una volta al mese più 50 mg quotidiani e d.d.s. 100 mg al dì. Naturalmente i dosaggi e i singoli farmaci vanno personalizzati a seconda della tolleranza individuale e fino alla negativizzazione, cioè alla scomparsa dei bacilli dal muco nasale e dalle lesioni cutanee. La OMS e le tante Associazioni filantropiche che agiscono in tutto il mondo nella lotta contro la L. hanno confezionato dei pratici blisters che contengono i 3 farmaci con l’indicazione dell’uso. Questo presidio è distribuito per lo più nelle tante zone carenti di assistenza. La Lebbra oggi nel mondo Nel Congresso Mondiale del 1986 a L’Aja, il responsabile per la L. dell’OMS dott. Nordeen, incoraggiato forse dal buon andamento della campagna mondiale contro la poliomielite, annunciò che l’OMS si era dato un termine per l’eradicazione della L. nel mondo: il termine era l’anno 2000, ma le condizioni d’instabilità politica di tanti Stati o di interi continenti come l’Africa, il nuovo flagello dell’AIDS, non hanno permesso il mantenimento dell’impegno. Riporto senza commenti i dati riguardanti i nuovi casi di contagio in alcuni paesi nel 2000: India 495.000 Brasile 78.100 Mozambico 28.500 Indonesia 23.200 Riguardo al nostro Paese si può affermare che la vecchia epidemia è finalmente conclusa, i secolari focolai calabresi, liguri, pugliesi, si sono esauriti, rimangono in costante osservazione circa 400 pazienti con 3-4 nuovi casi l’anno di italiani residenti; il temuto aumento dovuto agli immigrati è stato contenuto grazie al lavoro svolto negli ultimi 20 anni dai 4 Centri Italiani (Genova, Messina, Cagliari, Gioia del Colle), non solo sotto il profilo diagnostico e terapeutico, ma anche per il lavoro di ricostruzione di vecchie lesioni grazie alle nuove tecniche chirurgiche e fisioterapiche. Tuttavia continua ad essere necessario un attento monitoraggio, soprattutto nei centri di accoglienza degli immigrati provenienti da paesi a rischio.
Giuseppe Barbieri
Professore a contratto presso la scuola di Specializzazione dell’Università di Bari;
Membro della Commissione Ministeriale in qualità di esperto per il Morbo di Hansen da 15 anni.




