da Leadership Medica n. 268 del 2008
Abstract
La riparazione del danno cerebrale provocato da patologie traumatiche, vascolari o degenerative dipende dalla capacità dei neuroni di rigenerare i loro assoni e di formare nuove sinapsi. Nel sistema nervoso centrale dei mammiferi adulti questi fenomeni sono impediti dalla presenza di molecole che inibiscono attivamente l’accrescimento assonale. Queste molecole sono presenti nel tessuto nervoso intatto, dove regolano i processi di plasticità strutturale per mantenere la specificità delle connessioni. La neutralizzazione dei meccanismi inibitori favorisce la crescita neuritica, ma non è sufficiente per stabilire, o ristabilire, contatti sinaptici organizzati in maniera funzionale. D’altro canto, l’interazione con l’ambiente esterno favorisce i fenomeni di plasticità modulando i meccanismi regolatori. L’esito dei processi di riparazione del sistema nervoso dipende, quindi, dalla triplice interazione fra le proprietà neuronali intrinseche, le molecole regolatrici estrinseche ed il mondo esterno. Le interazioni molecolari fra neuroni e microambiente hanno una funzione principalmente permissiva sui processi di crescita, mentre gli stimoli provenienti dal mondo esterno svolgono un ruolo istruttivo sulla distribuzione dei contatti neoformati. La comprensione di questi meccanismi è fondamentale per sviluppare strategie terapeutiche nelle quali manipolazioni molecolari sono combinate con protocolli di riabilitazione mirata.
Parole chiave: rigenerazione assonale, plasticità neurale, riabilitazione, sinaptogenesi, controllo della crescita, neurodegenerazione.
Sommario
- Introduzione
- I mediatori molecolari del controllo della crescita nel sistema nervoso
- Il significato biologico del controllo della crescita nel SNC dei mammiferi
- Proprietà neuronali intrinseche, molecole regolatrici estrinseche e mondo esterno
- Conclusioni – nuove prospettive per la riparazione del danno cerebrale
- Bibliografia
Introduzione
La capacità del sistema nervoso centrale (SNC) adulto di ripararsi spontaneamente in seguito ad una lesione traumatica, vascolare o degenerativa è estremamente ridotta. Di conseguenza, i difetti funzionali provocati dal danno cerebrale sono spesso permanenti e fortemente invalidanti. Negli ultimi decenni, numerosi studi sono stati dedicati ad indagare i meccanismi biologici che impediscono la rigenerazione nel SNC adulto, ed a sviluppare strategie terapeutiche efficaci nel promuovere i processi riparativi. La ricerca di base in questo campo ha dimostrato che la mancata riparazione del danno neurale è principalmente attribuibile a due ordini di fattori concorrenti: 1) i neuroni maturi perdono gran parte del loro potenziale intrinseco di crescita; 2) diverse molecole che inibiscono la crescita neuritica sono presenti nell’ambiente del SNC adulto. Sorprendentemente, queste molecole non vengono espresse in conseguenza della lesione, ma compaiono nel corso della maturazione fisiologica del tessuto nervoso. In altre parole, se si eccettuano i componenti dei tessuti cicatriziali, i fattori che impediscono i processi rigenerativi sono elementi costitutivi del tessuto nervoso intatto. Ne consegue che comprendere il significato biologico del controllo della crescita in condizioni normali è un passaggio cruciale per capire i meccanismi che impediscono il successo dei processi rigenerativi. In questo articolo si affronteranno questi quesiti e si discuteranno alcune strategie dirette a favorire la riparazione del danno cerebrale interferendo con i meccanismi di controllo della crescita.
I mediatori molecolari del controllo della crescita nel sistema nervoso
La riparazione di tessuti danneggiati è solitamente sostenuta dalle cellule sopravvissute, le quali proliferano, si differenziano e si integrano nella trama della struttura lesa. Nel SNC adulto, la generazione di nuovi neuroni avviene solo in alcuni specifici distretti e riguarda un numero limitato di fenotipi neuronali. Di conseguenza, la riparazione spontanea del SNC non può fare affidamento sull’aggiunta di nuove cellule nervose, ma è completamente sostenuta da modificazioni adattative dei neuroni sopravvissuti alla lesione. Tali modificazioni comprendono sia la rigenerazione dei neuriti sezionati, che la riorganizzazione delle connessioni risparmiate dalla noxa patogena. Recenti scoperte nel campo dei trapianti neurali e delle cellule staminali suggeriscono la possibilità di introdurre nuovi neuroni nel SNC adulto. Anche in questo caso, tuttavia, l’esito favorevole della procedura dipende esclusivamente dalla capacità delle cellule donatrici di integrarsi nei circuiti del cervello ospite. Di conseguenza, in ogni condizione la riparazione del danno nervoso è fondamentalmente determinata da processi di accrescimento neuritico e neosinaptogenesi.
Il rimodellamento dei processi nervosi e la formazione di nuove sinapsi (solitamente definiti come “plasticità neurale”) sono anche il substrato strutturale dei processi di apprendimento o di adattamento fisiologico del sistema nervoso al modificarsi delle condizioni ambientali. Tuttavia, al fine di garantire la specificità dei contatti sinaptici all’interno dei circuiti complessi del SNC dei mammiferi, è necessario esercitare uno strettissimo controllo sulla crescita neuritica. Nel SNC adulto questa funzione è svolta da diversi fattori che appartengono a due categorie principali: proteine associate alla mielina e componenti della matrice extracellulare (Fig. 1). Oltre a queste sostanze, alcune proteine che guidano la navigazione neuritica durante lo sviluppo embrionale partecipano all’azione di controllo nel cervello adulto, ma il loro ruolo effettivo rimane per il momento da definire.
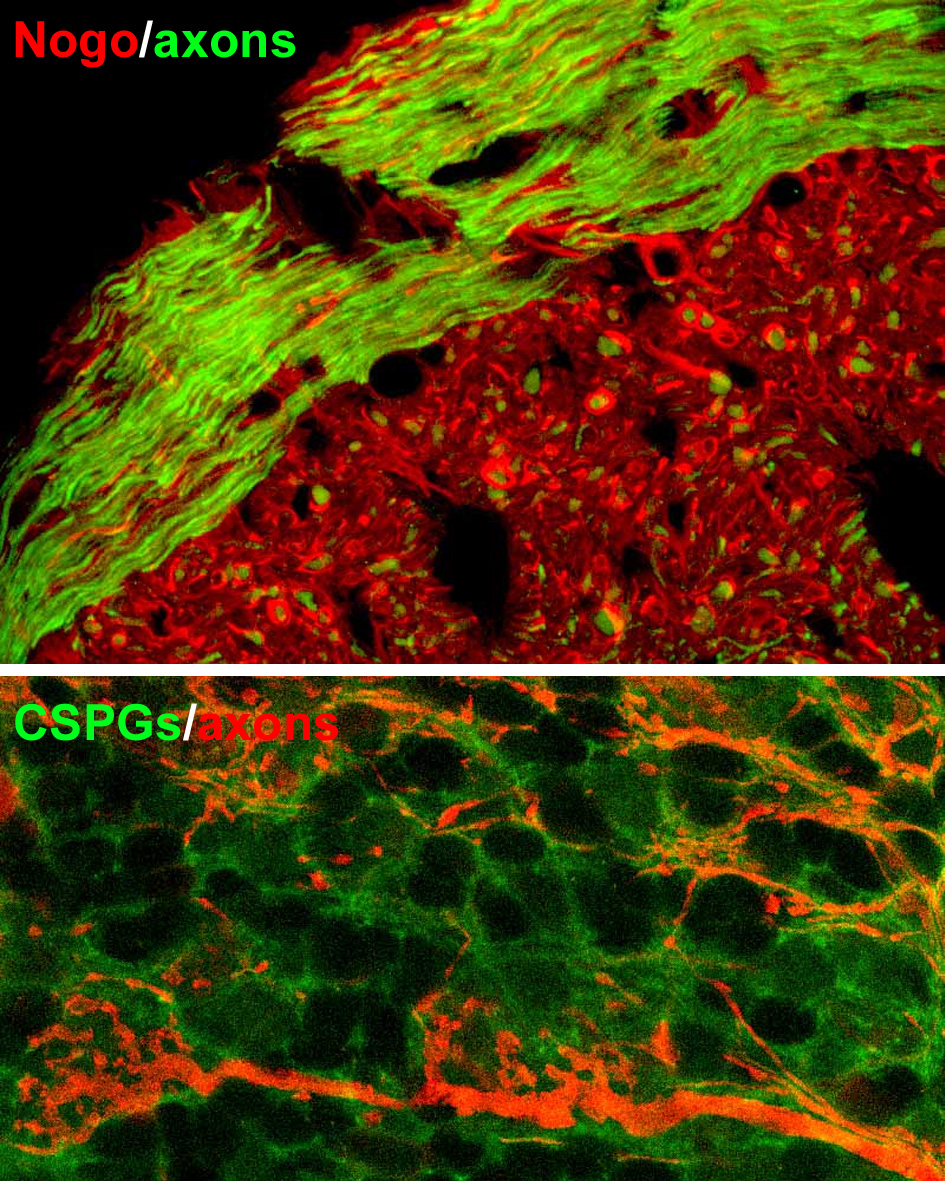
Il pannello superiore mostra la distribuzione di Nogo-A negli oligodendrociti maturi (in rosso, in verde sono marcati gli assoni);
in quello inferiore si può apprezzare la matrice formata dai CSPG (in verde) intorno agli assoni ed alle terminazioni (in rosso).
Gli inibitori associati alla mielina centrale comprendono la proteina Nogo-A, la prima molecola di questa categoria scoperta circa venti anni addietro, la glicoproteina della mielina degli oligodendrociti (Omgp) e la glicoproteina associata alla mielina (MAG). Queste tre proteine, che sono presenti nella mielina centrale matura, condividono un unico recettore espresso sulla superficie dell’assone, chiamato “recettore di Nogo” (NgR). La stimolazione di NgR mette in moto una cascata di segnalazione intracellulare che induce il collasso e la retrazione dei coni di crescita attraverso l’attivazione della piccola GTPasi RhoA.
Fra i componenti della matrice extracellulare, i meglio caratterizzati come fattori inibenti la crescita neuritica sono i condroitin-solfato proteoglicani (CSPG). Diversi tipi di CSPG sono espressi nel SNC, dove costituiscono il maggior componente delle reti perineuronali, fitti intrecci di matrice che avvolgono la superficie di alcuni tipi di neuroni. I CSPG sono anche presenti in gran quantità nelle cicatrici gliali che si formano nel tessuto nervoso lesionato, dove contribuiscono ad inibire la rigenerazione assonale. Il meccanismo d’azione attraverso il quale i CSPG arrestano l’allungamento neuritico non è del tutto chiaro, ma alcune osservazioni suggeriscono che anch’essi agiscano sulla cascata di RhoA.
Negli ultimi decenni sono state esplorate diverse strategie per favorire la riparazione nervosa neutralizzando le molecole inibitorie o le relative cascate di traduzione del segnale. Queste procedure, che comprendono l’applicazione di anticorpi neutralizzanti, la degradazione enzimatica, manipolazioni genetiche ed altro ancora, hanno dimostrato che è possibile incrementare i processi rigenerativi, ma non hanno permesso di ottenere una completa riparazione anatomica con il relativo recupero funzionale. Risultati sovrapponibili sono stati ottenuti attraverso manipolazioni dirette a potenziare le proprietà intrinseche di crescita dei neuroni danneggiati. Di conseguenza, le strategie d’intervento esclusivamente dirette ad interferire con i meccanismi molecolari della rigenerazione nervosa non paiono da sole sufficienti per risolvere il problema della riparazione del danno nel SNC.
Il significato biologico del controllo della crescita nel SNC dei mammiferi
La formazione delle guaine mieliniche e delle reti perineuronali sono eventi fondamentali che marcano la fase di maturazione definitiva del tessuto nervoso, parallelamente alla chiusura dei periodi critici per la plasticità neurale dipendente dell’esperienza. Questo modello implica che, dopo un periodo di intensa plasticità, nel quale i circuiti nervosi sono plasmati in modo da rispondere a specifiche condizioni ambientali, i meccanismi di crescita devono essere smorzati per mantenere l’organizzazione sinaptica costruita. Nel corso dell’evoluzione, la crescente complessità dei circuiti nervosi, insieme con l’emergere di maggiori capacità di adattamento all’ambiente, hanno determinato la necessità di meccanismi di controllo della crescita sempre più stringenti. In assenza di tali meccanismi restrittivi la semplice plasticità fisiologica potrebbe indurre un progressivo deterioramento dell’organizzazione delle connessioni, mentre i processi rigenerativi finirebbero per determinare la formazione di via aberranti e connessioni non specifiche. In entrambi i casi, la crescita incontrollata porterebbe al caos anatomico e, cosa anche più importante, alla comparsa di anomalie funzionali. In altre parole, l’inibizione della crescita, e della rigenerazione, sarebbe il prezzo da pagare per la complessità del nostro sistema nervoso. E’ davvero così?
A causa del ridottissimo numero di assoni che rigenerano, è praticamente impossibile definire se i processi riparativi del SNC siano capaci di ristabilire l’organizzazione originaria delle mappe di proiezione. Tuttavia, se consideriamo alcune specie di vertebrati inferiori o il sistema nervoso periferico dei mammiferi, dove la rigenerazione è più vigorosa, possiamo trovare alcune indicazioni per rispondere a questo quesito. Nella maggior parte di questi casi, la rigenerazione assonale, pur efficace, risulta poco orientata ed incapace di riformare connessioni organizzate. Ne consegue che il recupero funzionale è spesso limitato e, talvolta, insorgono veri e propri disturbi e disfunzioni. La sindrome post-paralitica, che compare dopo anastomosi del nervo faciale, è un esempio paradigmatico di questo genere di fenomeno. Nonostante ciò, se si applicano specifici protocolli di addestramento o riabilitazione, l’organizzazione delle connessioni riparate può essere molto migliorata con significativi benefici dal punto di vista del recupero funzionale. Queste osservazioni indicano che, sebbene le interazioni cellulari e molecolari non siano sufficienti per rigenerare pattern sinaptici organizzati e funzionali, specifiche interazioni con l’ambiente esterno possono modellare le connessioni neoformate in maniera adattativa. E’ interessante notare come questi meccanismi dipendenti dall’esperienza non agiscano solo sul circuito direttamente danneggiato, ma possano anche riguardare strutture distanti, coinvolte negli stessi compiti funzionali.
Conclusioni sovrapponibili si possono trarre considerando gli esperimenti nei quali i meccanismi di controllo della crescita sono stati modificati nel cervello intatto. Anche in assenza di lesione, la neutralizazione delle proteine della mielina o la rimozione dei CSPG determinano fenomeni di crescita assonale aberrante. Tuttavia, questi effetti sono transitori ed i pattern neuritici originari sono ristabiliti non appena le molecole regolatrici ricompaiono nel microambiente del SNC. Quindi, la rimozione dei fattori inibitori scatena la crescita assonale, ma questo non basta per formare nuovi contatti stabili. Perché è così?
Per poter essere compatibili con una funzione adattativa, i circuiti nervosi nel cervello adulto o in via di sviluppo devono essere plasmati in accordo con le interazioni dell’intero organismo (e del suo sistema nervoso) con l’ambiente circostante (in una parola: l’esperienza). Di conseguenza, anche nel caso in cui le proprietà di crescita siano grandemente potenziate, l’organizzazione dei contatti neoformati dipenderà, in ultima analisi, dalla natura della specifica esperienza. Per esempio, la rimozione dei CSPG o degli inibitori mielinici nella corteccia visiva adulta non induce alcuna modificazione significativa delle colonne di dominanza oculare, a meno che non sia associata alla chiusura di una palpebra (deprivazione monoculare), una procedura che determina un’inusuale sbilanciamento nell’esperienza visiva binoculare. In altri termini, le connessioni formate (o riparate) sono sempre congruenti con la relativa esperienza: una specifica interazione con l’ambiente circostante determinerà una distribuzione delle connessioni appropriata per quella interazione. Il risultato finale di qualsiasi processo plastico o rigenerativo dipenderà, quindi, dalla triplice interazione fra le proprietà neuronali intrinseche, le molecole regolatrici estrinseche ed il mondo esterno (Fig. 2). In questo meccanismo, l’equilibrio fra fattori neuronali ed ambientali determina il livello di capacità plastica del circuito, mentre gli stimoli esterni dirigono la disposizione delle connessioni neo-formate. Le interazioni molecolari hanno una funzione essenzialmente permissiva, mentre l’esperienza svolge un ruolo principalmente istruttivo.

Proprietà neuronali intrinseche, molecole regolatrici estrinseche e mondo esterno
Per molti anni la ricerca sulla rigenerazione e plasticità neuronale è stata principalmente diretta a comprendere i meccanismi cellulari e molecolari che favoriscono o impediscono l’allungamento dei processi nervosi. Allo stesso tempo, però, osservazioni su animali da laboratorio mantenuti in ambiente arricchito hanno dimostrato come l’esposizione a stimoli ambientali rilevanti abbia effetti profondi sulla struttura e sulla funzione del sistema nervoso, anche in individui adulti. Sorprendentemente, si è prestata poca attenzione ai meccanismi attraverso i quali gli stimoli esterni influenzano le interazioni molecolari fra cellule nervose e microambiente. Soltanto alcuni studi recenti hanno iniziato a far luce su questi aspetti.
Un aumento dell’attività nervosa, ottenuta per mezzo di stimolazione elettrica o farmacologica, induce la modificazione del contenuto di CSPG nella matrice di diverse regioni cerebrali, quali ad esempio l’ippocampo. Ancora più interessante è che simili modificazioni possono essere prodotte anche da stimoli fisiologici. Per esempio, un sovraccarico di sale nella dieta determina fenomeni di plasticità sinaptica nei neuroni magnocellulari dell’ipotalamo. Questa riorganizzazione è facilitata dalla contemporanea riduzione di particolari tipi di CSPG nelle reti pericellulari che avvolgono questi neuroni.
Gli stimoli ambientali possono anche influire sull’espressione di molecole neuronali associate alla crescita. Ad esempio, un’intensa attività fisica accelera la rigenerazione dei nervi periferici. Questo effetto è accompagnato da una sovraespressione di diversi geni neuronali, fra cui alcuni componenti dei coni di crescita e proteine necessarie per assemblare le sinapsi. L’attività motoria agisce direttamente sull’espressione di sostanze neurotrofiche, come il BDNF, che a loro volta modificano il pattern di espressione dei geni associati alla crescita nei neuroni attivati. In accordo con questa idea, è stato recentemente dimostrato che gli effetti dell’ambiente arricchito sullo sviluppo delle reti neurali retiniche sono aboliti nei topi knockout per il gene che del BDNF. Nell’insieme, queste osservazioni indicano che gli stimoli ambientali inducono la plasticità neuritica modulando sia i determinanti intrinseci neuronali che le molecole regolatrici presenti nel microambiente del SNC. L’effetto sembra essere mediato dall’attività elettrica che fluisce attraverso i circuiti stimolati. In altri termini, l’attivazione di specifici circuiti nervosi produce uno spostamento dell’equilibrio fra meccanismi promoventi ed inibenti la crescita assonale in modo da favorire le modificazioni plastiche.
Un aspetto rilevante di questi fenomeni è la loro alta specificità (Fig. 3). Infatti, se la modulazione dei meccanismi di controllo della crescita indotta da stimoli esterni è mediata dall’attivazione dei relativi circuiti nervosi, le modificazioni molecolari conseguenti sono circoscritte agli stessi. In questo modo, l’interazione con il mondo esterno regola i dispositivi di controllo ed induce modificazioni plastiche solo in quelle strutture che partecipano all’esecuzione di quel particolare compito funzionale.
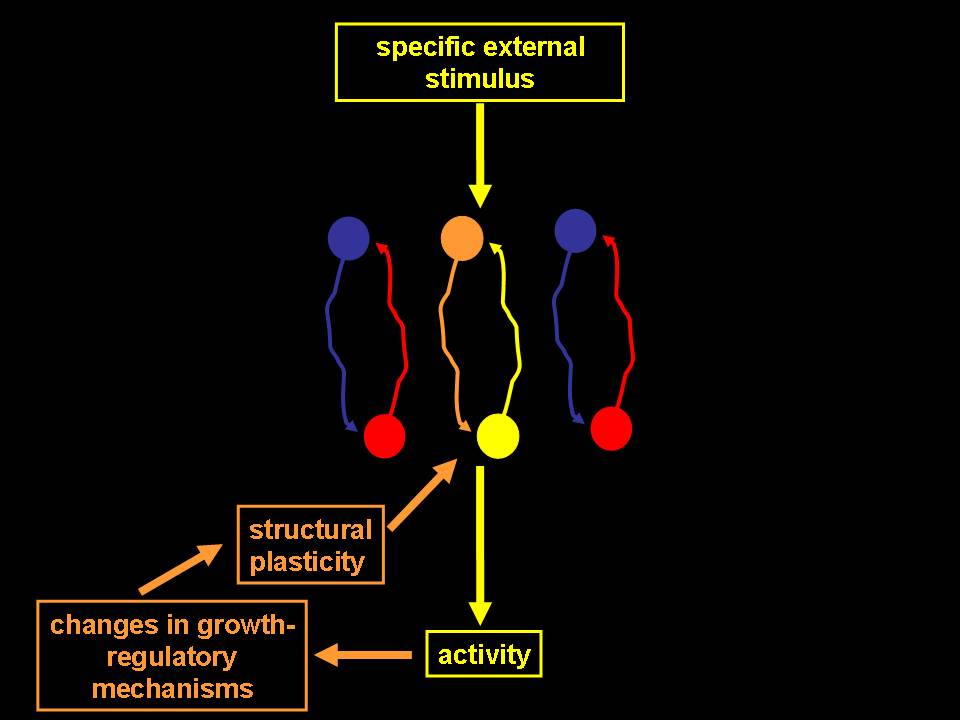
Ogni specifico stimolo esterno attiverà solo determinati circuiti nervosi e, quindi, determinerà condizioni favorevoli per i processi plastici solo in quei circuiti, preservando la specificità delle connessioni eventualmente neoformate.
In questo ambito vale la pena ricordare che alcune particolari forme di esperienza possono perfino portare all’insorgenza di chiare disfunzioni in individui altrimenti normali. Movimenti rapidi e ripetitivi possono determinare una progressiva disgregazione delle mappe corticali somato-sensoriali o motorie, seguita da difetti del movimento. Una simile riorganizzazione aberrante dei circuiti nervosi sarebbe alla base di alcuni disturbi occupazionali, come il crampo dello scrittore o le distonie focali nei musicisti professionisti. Recenti studi mostrano, infatti, che queste sindromi neurologiche sono effettivamente associate con fenomeni di plasticità disadattativa, prodotti da un’attivazione eccessiva o abnorme di particolari circuiti sensori-motori. Va però rilevato che questi disturbi possono essere efficacemente trattati applicando specifici protocolli di rieducazione. Nonostante questi “effetti collaterali”, è chiaro che gli stimoli e ambientali, e l’esperienza in senso lato, sono in grado di influire sui meccanismi di regolazione della crescita ed indurre notevoli fenomeni di plasticità strutturale nei circuiti nervosi.
Conclusioni – nuove prospettive per la riparazione del danno cerebrale
Le osservazioni riportate in questo articolo mostrano come il recupero funzionale in seguito a danno cerebrale risulti sia dalla rigenerazione di assoni sezionati che dalla riorganizzazione di circuiti risparmiati dall’evento lesivo. Infatti, se la rigenerazione assonale è assolutamente necessaria per riparare una lesione traumatica del midollo spinale, il rimodellamento dei circuiti sopravvissuti è probabilmente cruciale nel caso di altri tipi di danno, come ad esempio nell’ictus. Negli ultimi decenni, la maggior parte degli sforzi è stata diretta a stimolare le proprietà rigenerative dei neuroni o a rimuovere i fattori inibitori. Risultati recenti mostrano come l’interazione fra organismo e ambiente favorisca i processi di crescita e, cosa anche più importante, modelli l’organizzazione delle connessioni neoformate in accordo con specifiche necessità funzionali. L’acquisizione di questi concetti è importante per la nostra comprensione di meccanismi biologici di base, ma è assolutamente cruciale in previsione di strategie applicative. E’ormai chiaro che un buon recupero funzionale può essere ottenuto solo attraverso la triplice interazione fra le cellule nervose, il micrambiente del SNC ed il mondo esterno. Di conseguenza, trattamenti terapeutici efficaci del danno cerebrale devono combinare manipolazioni molecolari, come la neutralizzazione di meccanismi inibitori, con specifici stimoli esterni, come quelli forniti da protocolli personalizzati di riabilitazione. L’azione concertata di queste procedure permetterà di incrementare la crescita neuritica pur garantendo la specificità delle connessioni neoformate. L’obiettivo di un’efficace riparazione del danno nel sistema nervoso è ancora lontano, ma alcune prospettive interessanti si schiudono davanti a noi.
Ferdinando Rossi
Dipartimento di Neuroscienze, Centro Rita Levi Montalcini, Istituto Nazionale di Neuroscienze, Università di Torino
Bibliografia
1. Berardi N, Pizzorusso T, Maffei L. Extracellular matrix and visual cortical plasticity: freeing the synapse. Neuron, 2004, 44: 905-908.
2. Buchli A, Schwab ME. Inhibition of Nogo: A key strategy to increase regeneration, plasticity and functional recovery of the lesioned central nervous system. Ann Med, 2005, 36: 556-567.
3. Bush SA, Silver J. The role of extracellular matrix in CNS regeneration. Curr Op Neurobiol, 2007, 17: 120-127
4. Corvetti L, Rossi F. Degradation of chondroitin sulphate proteoglycans induces sprouting of intact Purkinje axons in the cerebellum of the adult rat. J Neurosci, 2005, 25: 7150-7158.
5. Gianola S, Savio T, Schwab M, Rossi F. Cell-autonomous mechanisms and myelin-associated factors contribute to the development of Purkinje axon intracortical plexus in rat cerebellum. J Neurosci, 2003, 23: 4613-4624.
6. Pizzorusso T, Medini P, Berardi N, Chierzi S, Fawcett JW, Maffei, L. Reactivation of ocular dominance plasticity in the adult visual cortex. Science, 2002, 298: 1187-1189.
7. Pizzorusso T, Medini P, Landi S, Baldini S, Berardi N, Maffei L. Structural and functional recovery from early monocular deprivation in adult rats. Proc Natl Acad Sci USA 103: 8517-8522.
8. Quartarone A, Siebner HR, Rothwell JC. Task-specific hand dystonia: can too much plasticity be bad for you? Trends Neurosci, 2006, 29: 192-199.
9. Rossi F, Gianola S, Corvetti L. Regulation of intrinsic neuronal properties for axon growth and regeneration. Prog Neurobiol, 2007, 8: 1-28.
10. Vaynman S, Gomez-Pinilla F. License to run: exercise impacts functional plasticity in the intact and injured central nervous system by using neurotrophins. Neurorehabil. Neural Repair, 19: 283-295.




