da Leadership Medica n. 1 del 2000
Abstract
L’approvazione (maggio 1998) da parte dell’Unione Europea, della direttiva sulla protezione legale delle invenzioni riguardanti le biotecnologie, ha allineato l’Europa al trend internazionale. Tuttavia molti problemi restano insoluti.
La differenza, ad esempio, tra l’articolo 53 della "European patent convention" (EPC) che proibisce di brevettare varietà di piante ed animali, e la direttiva che afferma che si possono brevettare quelle invenzioni non applicabili tecnicamente ad una sola specie vegetale o animale (art. 12).
Inoltre l’interpretazione della specificità delle specie vegetali ed animali e quella contenuta nel "Threatening public order and morality" (che proibisce la brevettabilità) può avere dubbie interpretazioni in conseguenza delle differenti leggi presenti nei paesi dell’Unione Europea (la Danimarca, ad esempio, non ammette la brevettabilità degli animali transgenici).
Nonostante le difficoltà oggettive, le applicazioni delle biotecnologie alla medicina, veterinaria, ed agricoltura, sono in continua crescita.
La valutazione bioetica delle applicazioni della biotecnologia e dei loro effetti collaterali è obbligatoria al fine di collegare gli interessi della scienza e della produzione industriale con l’etica .
Questo è il significato iniziale dato da van Potter alla parola bioetica, come ponte verso il futuro.
Introduzione
Nel 1474 la Repubblica di Venezia votò la protezione di qualsiasi miglioramento di interesse pratico o commerciale.
Questa è probabilmente la prima disposizione legislativa di uno stato riguardante la possibilità di ottenere un brevetto.
Appare quindi evidente come anche prima della rivoluzione industriale fosse apprezzata la necessità di garantire con l’opportuna legislazione le proprietà intellettuali, gli investimenti ed i risultati così ottenuti.
Non conosciamo i tempi necessari all’epoca per emanare le norme di legge, tuttavia sappiamo che l’Europa ha impiegato anni per raggiungere una posizione comune sulla brevettabilità delle straordinarie innovazioni tecnologiche ottenute nelle decadi passate.
Infatti dopo più di 10 anni di dibattiti e voti negativi il parlamento europeo ha approvato una disposizione comune nel Maggio del 1998 (EC n. 19/98) sulla protezione legale delle invenzioni biotecnologiche.
La direttiva europea 98/44/CE dovrebbe ora essere recepita dalla legislazioni nazionali.
La logica della direttiva è di distinguere in natura quello che non è brevettabile, ed il processo di modifica o conoscenza scientifica (al fine di produrre varietà animali, o isolare sequenze del genoma etc.), e i loro prodotti (varietà di animali, piante, rDNA e correlate proteine...)
I processi ed i prodotti sono brevettabili. Vanno escluse quelle invenzioni che sono contrarie all’ordine pubblico ed alla moralità.
In effetti i vari articoli trattano sia l’esclusione dalla possibilità di ottenere brevetti, sia le caratteristiche che ne consentono l’ammissibilità:
I. invenzioni non brevettabili:
varietà di piante ed animali e "processi biologici essenziali per la produzione di piante ed animali" (art. 4.1); invenzioni contrarie alla morale e all’ordine pubblico (art 6.1); processi per la clonazione di esseri umani, uso di embrioni umani a fini industriali o commerciali, processi per modificare l’identità genetica di animali che possono causare la loro sofferenza senza alcun beneficio medico per l’uomo o per l’animale, e anche animali che derivino da questi processi (art. 6.2);
II. invenzioni brevettabili:
invenzioni che riguardano piante o animali se la fattibilità tecnica non è limitata ad una particolare varietà di pianta o di animale (art.4.2).
Ciò comprende anche il prodotto ottenuto attraverso questi processi (art. 4.3); un elemento isolato dal corpo umano o prodotto attraverso un processo tecnico, comprendendo anche la sequenza di un gene anche se la struttura dell’elemento è identica a quella dell’elemento naturale (art. 5.2); l’applicazione industriale di un sequenza intera o parziale di un gene (art. 5.3).
Inoltre è opportuno osservare come vi sia una discrepanza tra la direttiva e la convenzione europea concernente i brevetti, che contiene le norme che regolano l’European Patent Office (EPO, Munich, Germany).
L’articolo 53b dell’EPC proibisce la brevettabilità di varietà di piante ed animali mentre la direttiva afferma che "le invenzioni che riguardano animali o piante possono essere brevettate se la fattibilità dell’invenzione non è tecnicamente confinata ad una particolare pianta o varietà animale" (art.1b-ii).
La differenza evidenziata è importante perché il processo per produrre animali transgenici nelle varie specie può essere brevettato secondo le direttive europee, mentre ciò è dubbio per l’EPO (infatti la procedura per registrare in Europa il brevetto dell’onco-topo presentato da Phil Leder, University of Harvard, è a tutt’oggi pendente: dopo che vi è stato un primo rifiuto, è in essere il ricorso in appello presso la commissione preposta dell’EPO.
Aspetti legali e controversie che riguardano la direttiva dell’Unione Europea sulla possibilità di brevetto delle biotecnologie
L’Italia e l’Olanda hanno presentato appello contro alcuni aspetti della direttiva (il problema è la protezione della diversità delle piante e i metodi naturali di selezione in relazione all’uso di piante transgeniche).
La corte Europea di giustizia (Lussemburgo) sta esaminando l’appello.
In ogni caso tre problemi, legali, scientifico-legali, etico-legali vanno sottolineati:
I. la discrepanza tra la direttiva EU (art. 4.2) e l’EPC (art. 53 b) circa la brevettabilità- non brevettabilità delle varietà animali e vegetali
Le industrie desiderano l’approvazione delle norme della direttiva europea, che tutelano l’innovazione scientifica e la tecnologia derivata secondo gli standard americani; in secondo luogo vorrebbero la cancellazione dell’art. 53.b.
Tuttavia ogni nuova convenzione richiede l’approvazione dei parlamenti degli stati membri; naturalmente ciò è complesso da ottenere dato che ogni stato può avere posizioni diverse su punti essenziali, ad esempio la brevettabilità di animali transgenici (1).
Tuttavia è possibile integrare l’EPC, con una regolamentazione supplementare che naturalmente dovrebbe essere approvata dal comitato che governa l’EPC: ovviamente la regolamentazione aggiuntiva non può modificare regole essenziali.
Un’altra possibilità di modifica è la Conferenza Diplomatica tra gli stati che hanno sottoscritto la convenzione.
I lunghi negoziati (3-5 aa.) e l’incerto risultato sottolineano le difficoltà esistenti nel risolvere il problema.
II. aspetti legali ed etici
La direttiva 98/44CE ha un testo più semplice rispetto a quello bocciato nel 1995, tuttavia il concetto di sofferenza inadeguata (da parte degli animali) e di pericolo per l’ordine pubblico e per la morale sono presenti anche nel nuovo testo: questi concetti suggeriscono di valutazioni differenti tra i diversi stati (animali trans genici proibiti in Danimarca e permessi in altri stati, o xenotrapianti permessi in Spagna e senza legislazione negli altri paesi).
Per questi motivi esiste la fondata possibilità di procedimenti legali.
La conflittualità non riguarda ad esempio casi in cui la moratoria è totale come la clonazione di esseri umani, ma il problema di clonare un insieme di cellule, gli xenotrapianti etc.
Il dibattito su queste tematiche cresce quotidianamente e la soluzione dipende dalle diverse posizioni etiche (2,4).
Tendenze di sviluppo industriale in biotecnologia
Quali sono gli obiettivi di sviluppo per le biotecnologie?
Gli investimenti attuali nella scoperta di nuovi farmaci, nuove strategie terapeutiche e tecnologie innovative ad alto rischio possono essere analizzati sia per l’aspetto medico che per quello economico e legale.
Le autorizzazioni rilasciate per prodotti destinati alla biotecnologia medica dalla European Medicine Evaluation Agency (EMEA, London) sono state indirizzate verso tre aree:
I. proteine
recombinanti DNA (ormoni, modificatori di risposte biologiche, fattori di crescita, fattori della coagulazione)
follitropin-alfa, interferon-beta-ib, fattore settimo a, insulina umana, follitropina beta, disirudina, retephasetPa, epoietin-beta, interferon-beta, interferon beta 1a, benefix-coagulation factor nono;
II. vaccini
Vaccini combinati contro l’epatite B, difterite, tetano e pertosse; vaccino combinato per le epatiti A e B, vaccino pediatrico combinato per l’epatite B, difteria e tetano;
III. anticorpi monoclonali per scopi diagnostici e terapeutici
mo Ab CEA-Scan, anti melanoma moAb, moAb Leukoscan, imiglucerase (per la diagnosi della malattia di Gauche tipo 1), Rituximab moAb per il linfoma follicolare non-Hodgkin, linfoma, moAb per la profilassi del rigetto acuto nel trapianto di rene allogenico.
Le strategie attuali delle industrie possono essere valutate attraverso l’analisi delle biotecnologie mediche in sviluppo (tabella 1), mentre le tendenze su periodi medi possono essere comprese attraverso gli investimenti per ricerca e sviluppo fatti negli ultimi anni. Gli sforzi per la ricerca sulle applicazioni cliniche a breve termine sono concentrati principalmente sui vaccini e sugli anticorpi monoclonali mentre l’oncologia è il settore di maggior interesse.
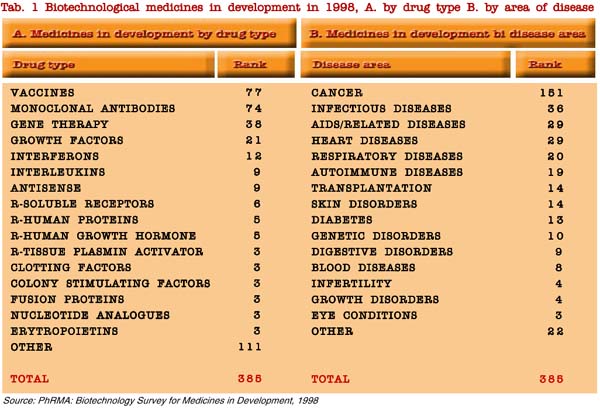
Appare opportuno osservare che i capitali investiti sono principalmente diretti verso la scoperta di nuovi farmaci e sulla somministrazione di farmaci per le malattie più comuni (oncologia, malattie cardiovascolari, neurologiche, ed immuno infiammatorie), con un incremento significativo dal 1997 al 1998 per le ultime citate e per l’ambiente agro-alimentare, ed una riduzione per i farmaci metabolici ed i biomateriali. Il 50% degli investimenti è concentrato su tre aree (scoperta di nuovi farmaci, oncologia e tecnologie di supporto) su un totale di 20 aree di applicazioni (tabella 2).
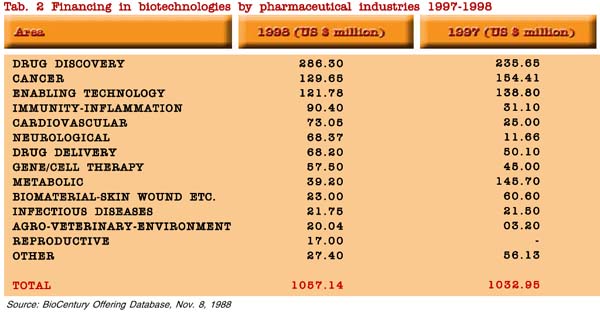
Un recente articolo ha analizzato le attuali tendenze industriali al fine di osservare le loro potenzialità e le difficoltà incontrate nel raggiungere le applicazioni cliniche (6).
Le considerazioni maturate sono riassunte nella tabella 3: è opportuno notare che le difficoltà incontrate per la diffusione di queste tecnologie sono dovute alla conferma (chimica di combinazione, terapia genica,) così come alla difficoltà di trasportare i modelli sperimentali alle applicazioni cliniche.

La ricerca biotecnologica è importante anche nel settore della biodiversità (piante ed animali): la biodiversità è il prodotto della millenaria selezione naturale e della diversificazione così ottenuta, il che è senz’altro positivo per l’uomo.
In questa situazione i paesi industrializzati hanno la tecnologia per selezionare le specie, per modificare singole piante ed animali, per brevettare le procedure utili a questi fini.
I paesi sottosviluppati hanno una grande varietà di piante e di animali che rischiano di essere ridotti da queste tecnologie.
I paesi industrializzati hanno le tecnologie per creare invenzioni ed ottenere royalty, mentre quelli sottosviluppati hanno la biodiversità di piante ed animali senza il diritto di percepire alcun vantaggio economico dalle industrie che utilizzano questa biodiversità.
Esempi di quanto detto sono i "taxans", sostanze antitumorali estratte dalle piante (ditirpene estratto dagli aghi e dalle bacche del Taxus brevifolia). Un altro esempio è costituito dagli "extremophiles", organismi capaci di sopravvivere in condizioni ambientali estreme e di grandi potenzialità per l’industria.
In ultimo una ambiziosa piattaforma di ricerca definita "proteo[no]mics" ha cercato di collegare una sequenza genica ad un fenotipo espresso in vari stati fisiologici e patologici: quando la sequenza di 3-4 miliardi di nucleotidi di dna basato su cromosomi umani sarà completata l’informazione dovrebbe essere correlata ai prodotti proteici: il proteome è stato definito come il "totale complemento proteico del genoma" (7).
Aspetti bioetici inerenti le biotecnologie: il ruolo delle istituzioni pubbliche e private
L’opinione comune dei governi e delle industrie è che l’uso delle biotecnologie deve essere studiato, nelle sue implicazioni etiche, sia per l’aspetto medico che per quello alimentare.
La prima osservazione è che la strategia delle industrie è ovviamente diretta ad un mercato ampio, quello ad esempio delle malattie con maggiore incidenza (tabella 1).
Per questo negli Stati Uniti a partire dal 1983 è stata definita la legislazione sugli "orphan drugs" (farmaci definiti in funzione dell’incidenza della patologia).
Nel giugno del 1998 la Commissione Europea ha presentato al Parlamento Europeo una legislazione basata su di un fattore di prevalenza stabilito a 5 pazienti per 10.000 abitanti (9).
Nello stesso periodo la rivoluzione genetica della biotecnologia applicata alla agricoltura suggerisce la possibilità dell’insorgenza di problematiche inerenti alla loro diffusione.
Il parlamento Europeo ha pertanto adottato emendamenti ad hoc alla direttiva 90/220/EC (10).
L’Unione Europea ed il Parlamento concordano nell’affermare che ogni nuova applicazione di una biotecnologia debba essere approvata da una Commissione ad Hoc.
Il Governo Americano, il Senato, il Servizio sanitario e le Agenzie Governative eseguono sondaggi aventi per oggetto l’opinione riguardo alle linee guida degli stati.
In particolare per i problemi emergenti quali l’etica delle ricerche sull’embrione umano (1999 : http://www.senate.gov),
Come risultato di questi sondaggi si è notato che tre quarti della popolazione americana è favorevole agli xenotrapianti, se non vi è disponibilità di organi umani (11,12).
Altri argomenti trattati nei sondaggi sono stati: implicazioni etiche nelle ricerche sulle cellule staminali umane (convegno organizzato dall’US National Bioethics Advisory Commission-NBAC). I risultati del convegno sono disponibili sul sito http://bioethics.gov/cgbin/bioeth-counter.p.
Il Presidente degli Stati Uniti diede il compito ai membri dell’NBAC di fornire linee guida sul tema: "la problematica etica delle ricerche sull’uomo.
Il rapporto fu pubblicato nel 1998 (13).
L’organizzazione europea delle industrie biotecnologiche (EuropaBio) ha costituito una commissione composta da otto membri con il compito di studiare diversi aspetti (etica, legge, medicina, veterinaria).
Pertanto è stata pubblicata una guida etica utile per la cura della salute e produzione di alimentari (http://www. europa-bio.be/publications/pg0 01. html).
Appare evidente che il futuro delle applicazioni e della ricerca per la biotecnologia si fondi su un reale equilibrio tra innovazione tecnologica, applicazioni industriali e il rispetto della dignità dell’uomo e del mondo vegetale ed animale.
Partendo dalla di chiarazione dei Diritti umani di Helsinki 1964 (11) fino alla definizione di bioetica di van Potter, un ponte verso un futuro sostenibile è stato aperto.
Luigi Frati
Dipartimento di Medicina Sperimentale e Patologia
Università "La Sapienza" Roma
Robin Foà
Dipartimento di Scienze Biomediche e Oncologia Umana
Università di Torino
Paola Frati
Facoltà di Legge
Università di Macerata e IRCCS Neuromed Pozzilli - Isernia




