Dall’Ospedale Pederzoli di Peschiera del Garda uno studio che fa luce sull’influenza che hanno le apnee notturne sulla sintomatologia da SARS-CoV-2
Abstract
Il fine di questo lavoro consiste nel studiare la funzionalità respiratoria durante il sonno nei pazienti Covid positivi, al fine di valutare la presenza della sindrome delle apnee notturne come fattore di rischio che predispone all’infezione da Covid-19.
Gli studi mostrano che le comorbidità nei pazienti Covid sono obesità, ipertensione, diabete e disturbi cardiovascolari. (6) Le stesse comorbidità sono presenti nelle persone che soffrono di sindrome delle apnee notturne. (9) Le apnee nel sonno causano una frammentazione del sonno ed una produzione di citochine (IL-6,IL-17 and TNFa); conseguentemente rappresenta una condizione pro-infiammatoria. (1)
La ragione consiste nel russamento: la vibrazione delle pareti molli causa un’infiammazione delle alte vie respiratorie e con il tempo, aumentando l’infiammazione, aumentano gli eventi respiratori.
Sono stati studiati 32 pazienti ospedalizzati Covid positivi, al tempo T0 e al tempo T1 , attraverso il monitoraggio cardiorespiratorio notturno, considerando alcuni parametri fisiologici quali il flusso nasale, i movimenti toraco-addominali, la posizione, il russamento, la frequenza cardiaca e il livello di ossigeno nel sangue. Lo strumento utilizzato per lo studio è il poligrafo Nox T3. Gli studi sono stati valutati con l’analisi manuale in accordo con le linee guida internazionali, con differenziazione della natura degli eventi non solo apnoici ma anche ipoapnoici.
Sette pazienti non avevano comorbidità, 25 di loro presentavano comorbidità come disturbi cardiovascolari, diabete, patologie respiratorie, ostruzione delle alte vie aeree. 27 pazienti erano in sovrappeso oppure obesi. I risultati del monitoraggio cardiorespiratorio notturno al tempo T0 mostrano che 4 pazienti sono negativi, 15 pazienti hanno una Osas lieve, 5 pazienti hanno una Osas moderata e 8 pazienti hanno Osas severa.
Tra i pazienti negativi, tre presentano patologie cardiovascolari.
Il monitoraggio cardiorespiratorio notturno è stato ripetuto al tempo T1 su 29 pazienti (2 pazienti sono deceduti, 1 paziente era assente). 1 paziente è negativo, 15 pazienti hanno Osas lieve, 7 pazienti hanno Osas moderata, 6 pazienti hanno Osas severa.
Riassumendo, l’ 87% dei pazienti ospedalizzati Covid positivi ha Osas a T0 e il 93% dei pazienti ospedalizzati Covid positivi presenta Osas a T1.
Tutte le variabili studiate come BMI, età, tempo supino, tempo di sonno, saturazione d’ossigeno, frequenza respiratoria, comorbidità, non erano statisticamente significative. Non è stata trovata nessuna correlazione tra le variabili studiate e l’evoluzione della sindrome delle apnee notturne all’interno dell’infezione da Covid-19.
In aggiunta, 55 pazienti Osas noti non in trattamento sono stati paragonati alla popolazione generale in Veneto durante Febbraio 2021 relativamente all’infezione da Covid. 9 su 55 pazienti Osas noti sviluppò il Covid: il 16%.
Paragonando questi dati con tutta la popolazione del Veneto, si è trovato che il 7% ha contratto l’infezione da Covid-19. Queste percentuali sono significativamente differenti.
In considerazione di ciò, l’Osas potrebbe essere un fattore di rischio per l’infezione da Covid-19.

INTRODUZIONE
L’apnea ostruttiva del sonno (OSA) è un disturbo respiratorio caratterizzato dalla riduzione del calibro delle vie aeree superiori durante il sonno, russamento abituale e persistente, ogni notte da almeno sei mesi ed episodi ripetitivi di cessazione della respirazione notturna, parziale o totale, dovuti al collasso delle vie aeree superiori; ogni pausa può durare da pochi secondi a pochi minuti e si verificano molte volte durante la notte. Gli eventi di ipopnee e apnee determinano una riduzione del livello di ossigeno nel sangue, condizione chiamata ipossiemia. (2) (10) L’Osa provoca malattie cerebrali, metaboliche e cardiovascolari e alcune conseguenze fisiopatologiche quali sforzo respiratorio e aumento della pressione negativa endotoracica, attivazione vegetativa simpatica, microrisveglio del sonno, ipossiemia intermittente, processi infiammatori (8); produce un’immunoregolazione alterata e instabilità respiratoria durante il sonno. (3) Da qui nasce l’idea di questo studio. Poiché la sindrome delle apnee notturne provoca un’infiammazione delle vie aeree superiori, (4) (5) ci si chiede se i pazienti affetti da questa patologia possano contrarre più facilmente l’infezione da Covid, se ci sono variabili che possono influenzare l’indice di Apnea/Ipopnea (AHI) al tempo T1 e se la presenza delle comorbilità influenzano l’andamento dell’Osas.
MATERIALI E METODI
In primo luogo, sono stati considerati 32 pazienti Covid positivi ospedalizzati e il loro sonno è stato studiato al tempo T0 e T1 (misure ripetute dello studio longitudinale). Lo studio del sonno è valutato mediante monitoraggio cardiorespiratorio notturno effettuato nel corso di una notte. E’ stato utilizzato il poligrafo Nox t3 dotato di cintura toracica e addominale, sensore di posizione, russamento derivato dal segnale audio, pletismografia, saturazione notturna e frequenza cardiaca. Considerando le linee guida durante la pandemia di Covid, la cannula nasale per il rilevamento del flusso d’aria non è stata utilizzata. L’analisi del flusso è stata eseguita dal parametro Xflow consentito dall’uso di bande pletismografiche. Le bande pletismografiche sono state utilizzate per registrare i movimenti addominali toracici, i cui vantaggi sono elencati di seguito:
• permettono di misurare la variazione dei volumi al di sotto delle bande;
• in qualsiasi posizione del corpo possono misurare la parte del torace e dell’addome che si muove;
• il segnale ottenuto è molto simile a quello del termistore e riproduce inspirazione ed espirazione.
Gli studi sono stati valutati con analisi manuale secondo le linee guida internazionali, con differenziazione della natura degli eventi non solo apnoici ma anche ipoapnoici. I pazienti esaminati erano pazienti casuali con uno stato clinico lieve all’ingresso: significa che avevano al massimo 1 litro di ossigeno. Pertanto, non sono stati considerati solo i pazienti con caratteristiche cliniche che presuppongono un sospetto di malattia. È stato compilato un database considerando varie variabili: età, morte, sesso, BMI al tempo T0 e tempo T1, frequenza respiratoria durante il sonno al tempo T0 e T1, saturazione media al tempo T0 e T1, livello Osas al tempo T0 e T1, AHI al tempo T0 e T1 Tempo T0 e T1. Si ricorda che l’AHI è l’indice di apnea e ipoapnea/ora di sonno. Il livello di Osas dovrebbe essere determinato solo considerando gli eventi ostruttivi. Abbiamo 3 livelli di Osas: se l’AHI è compreso tra 5 -14 abbiamo Osas lieve, tra 15 e 29 Osas moderata, > 30 Osas grave. Sono state considerate alcune variabili: il tempo di posizione supina al tempo T0 e al tempo T1 e quattro tipi di comorbidità. La comorbilità 1 rappresenta le ostruzioni delle vie aeree superiori come la deviazione del setto nasale, l’ipertrofia dei turbinati, l’ipertrofia tonsillare. La comorbilità 2 rappresenta malattie cardiovascolari come ipertensione, fibrillazione atriale, cardiopatia ipertensiva. La comorbilità 3 rappresenta il diabete. La comorbilità 4 rappresenta malattie respiratorie come asma, BPCO, enfisema.
In aggiunta sono stati considerati 55 pazienti Osas non in trattamento e sono stati paragonati con la popolazione generale del Veneto durante il mese di Febbraio 2021 in relazione alla positività all’infezione da Covid-19.
Analisi statistica Il test T di Student, il test U di Mann-Whitney e il test Chi Square sono stati utilizzati rispettivamente per le variabili normali, ordinali e nominali. Il test T accoppiato è stato utilizzato per le misure ripetute. La correlazione tra le variabili è stata testata utilizzando il modello di regressione lineare semplice e multivariato. Il modello di regressione logistica è stato applicato per trovare i veri predittori indipendenti per lo sviluppo di un’OSA severa, considerando come variabile dipendente l’OSA.
RISULTATI
I risultati dello studio, riferiti ai pazienti Covid ricoverati, mostrano che l’87% dei pazienti Covid ricoverati ha Osas a T0 e il 93% dei pazienti Covid ricoverati ha Osas a T1.
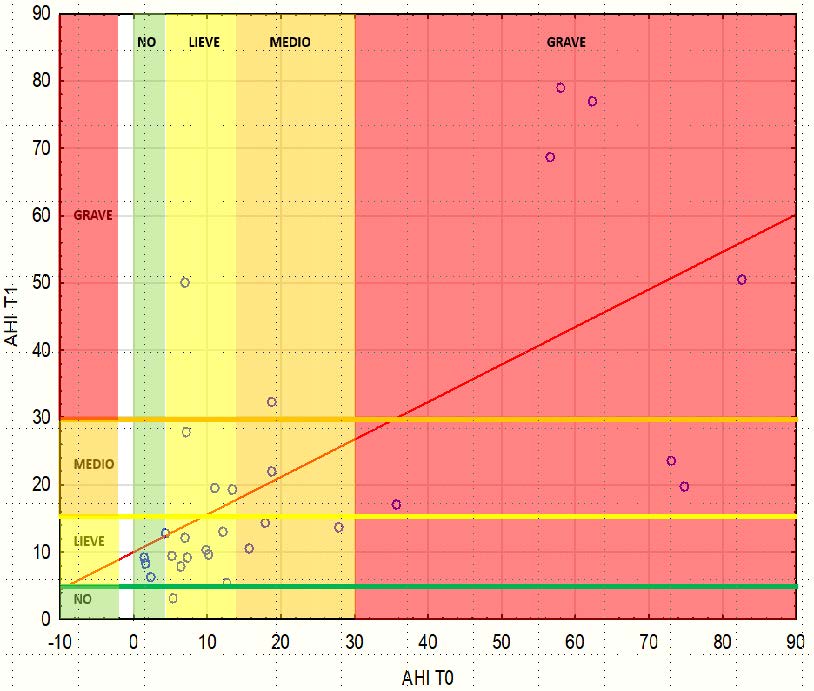
Tab. 1: correlazione lineare tra AHI T0-AHI T1
Facendo riferimento alla correlazione lineare (Tab. 1), la relazione tra il livello di Osas al tempo T0 e il livello di Osas al tempo T1 è abbastanza lineare nel primo periodo per il livello di Osas lieve-moderato. Per il livello Osas grave la previsione non funziona più. Il fatto interessante è che la linea si comporta indipendentemente dalle variabili considerate.
Poiché AHI al tempo T1 determina la classificazione dei pazienti, potremmo chiederci quali sono le variabili correlate con AHI al tempo T1 (Tab 2).
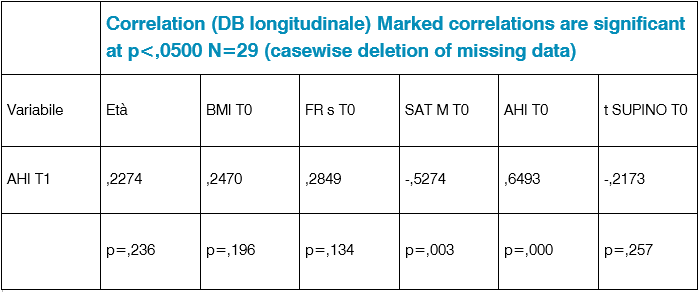
Tab. 2: Correlazione DB longitudinale
Da un punto di vista della correlazione lineare, ne risultano due: la saturazione di ossigeno e AHI. Migliore è la situazione all’inizio in termini di saturazione di ossigeno e livello di Osas, migliore è la situazione al tempo T1. Ci sono situazioni estreme in cui la linearità non è affatto preservata (Tab. 3-4-5).
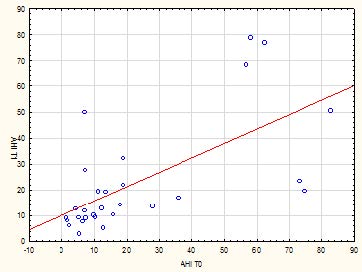
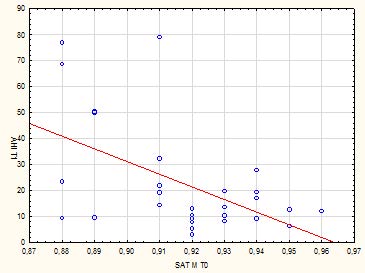
Tab 3: Correlazione lineare tra AHI a t1 e saturazione d’ossigeno a T0
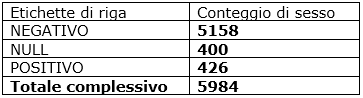
Tab. 4: dati popolazione generale Veneto a Febbraio 2021
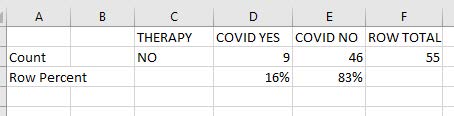
Tab. 5: pz osas non trattati febbraio 2021
Il confronto con la popolazione generale in Veneto durante febbraio 2020 mostra che il 7% della popolazione generale aveva il Covid contro il 16% della popolazione Osas.
DISCUSSIONE
Studio Misure ripetute
È stata considerata una popolazione di soggetti Covid ricoverati e sono stati valutati i diversi gradi di Osas presenti. Abbiamo osservato cosa succede al tempo T0 e al tempo T1 per vedere se le variabili considerate variano nel tempo: cambiano solo la frequenza respiratoria nel sonno e la percentuale del tempo in posizione supina. È strano notare che né la saturazione né l’AHI cambiano nel tempo. Motivo dovuto al fatto che, in media, queste due variabili sono rimaste le stesse ma a seconda del gruppo considerato, qualcuno è andato meglio qualcuno peggio. La tabella relativa alla variazione della gravità dell’Osa tra T0 e T1 mostra che i 4 pazienti normali a T0 avevano tutti Osas lieve a T1. I 13 pazienti che erano lievi a T0, tre a T1 sono diventati medi, 8 sono rimasti lievi, uno è migliorato, uno è peggiorato. Di quelli che avevano Osas medio a T0, che erano 5, uno rimane lo stesso, uno peggiora e 3 diventa lieve. Dei 7 gravi a T0, 3 migliorano e 4 rimangono invariati. La cosa interessante da vedere è se ci sono valori predittivi nel trend. Misuriamo il grado di gravità di Osas in virtù di AHI, quindi poiché AHI a T1 determina la classificazione dei pazienti, potremmo chiederci quali sono le variabili correlate con AHI al tempo T1 (età, frequenza respiratoria, BMI, supino t, AHI) . Da un punto di vista della correlazione lineare, due sono correlati: saturazione di ossigeno e AHI. Maggiore è la saturazione, minore sarà AHI: all’aumentare della saturazione AHI diminuisce. Infatti, l’indice di correlazione è inverso. Nel grafico di correlazione monovariata è stato messo AHI T0 in x e AHI T1 in y. I punti intorno alla linea retta ci stanno abbastanza fino a AHI T0 a 30.
Più si va avanti, cioè peggiore è la situazione iniziale, più accade tutto il contrario di tutto: in questi casi la retta non funziona più, c’è qualcosa di strano che cambia. Per quanto riguarda la relazione inversa tra saturazione di ossigeno all’istante T0 e AHI all’istante T1: più la saturazione aumenta, più AHI si riduce, ma ci sono situazioni estreme in cui la linearità non è affatto preservata. Prevedere qualcosa in termini di gravità dell’OSA (sarà lieve, moderata) è impossibile perché i casi sono ridotti. Quindi l’idea è stata quella di prevedere se ci sarà una Osas grave, perché si distingue da tutto il resto. Quindi, si è presa come dicotomizzazione Osas grave a T1 o Osas non grave a T1. Di conseguenza, tutti quelli gravi furono messi in una categoria e gli altri in un’altra categoria. In questo modo si vede che a T0 c’erano 7 gravi e a T1 quelli gravi erano 6: c’è concordanza. Di quei 7 severi, 4 ci sono rimasti e 3 sono non gravi, viceversa di quelli che a T1 erano gravi 4 c’erano già prima e 2 sono nuovi. La regressione logistica multivariata ha mostrato che solo AHI a T0 era un fattore predittivo indipendente. Quindi abbiamo calcolato la curva roc: l’AUC (area sotto la curva) era 0,81 con limiti di confidenza da 0,6 a 1: questo ci dice che 0,81 sarebbe una discreta capacità predittiva ma è molto variabile perché abbiamo una dimensione del campione relativamente piccola. Utilizzando il metodo Youden, il cut-off dell’AHI a T0 identificato come 18,75. Considerando il cut-off calcolato, è stata creata una tabella 2x2 per la corretta allocazione dei casi. La sensibilità e la specificità erano buone (circa 80%) e l’OR era 23 (questo significa che un paziente con AHI T0 maggiore di 18,75 ha 23 volte la probabilità di un’OSA grave a T1, rispetto a un paziente con AHI a T0 inferiore a 18,75) con ampi limiti di confidenza a causa della dimensione del campione relativamente piccola. Tuttavia AHI a T0 è un vero fattore di rischio perché entrambi i limiti sinistro e destro sono superiori al valore 1 che differenzia i fattori di rischio dai fattori predittivi.
Si sono verificati cinque casi di previsione errata. Per quanto riguarda la tabella delle previsioni errate; quelli che dovrebbero avere Osa severo ma non ce l’hanno. C’è una certa capacità di previsione ma c’è incertezza perché accade un po’ di tutto. Cosa collega AHI T1 a tutto il resto? Il BMI non è associato. Non può esserci correlazione senza un’associazione significativa. Le variazioni del BMI e della percentuale del tempo supino sono giustificate per il singolo paziente ma non nel gruppo. L’andamento dell’Osas nel tempo non è influenzato da alcuna variabile. Questo database cerca di rispondere alla domanda di quale sia l’andamento dell’Osa nel tempo. È un tentativo di prevedere l’andamento dell’Osas in un gruppo di pazienti ricoverati per Covid. È importante sottolineare che i casi di Osas gravi non sono molti quindi la stima è imprecisa. Esiste quindi una certa capacità predittiva ma molti casi sono fuori dalla linea di correlazione perché l’andamento dell’AHI non può essere spiegato da altri fattori presenti contemporaneamente. Non erano significativamente correlati nell’analisi multivariata poiché la dimensione del campione non è sufficiente. Il vero motore è AHI perché è su questo che si basa la definizione dei livelli Osas. Sono stati fatti dei tentativi per mettere in relazione i miglioramenti con i peggioramenti. Ma una persona che va da lieve a grave è diversa da un’altra che va da lieve a moderata, quindi da grave a lieve e da grave a moderato. Quindi anche facendo una serie di migliorie sulla stessa categoria peggiorata/migliorata, i dati sono troppo contrastanti, è impossibile prevedere qualcosa vista l’enorme discrepanza nel concetto di migliorato/peggiorato stesso.
Un’altra cosa da tenere a mente è che qui siamo in una previsione un po’ strana perché diciamo previsione di avere Osas grave rispetto a Osas non grave: dobbiamo vedere le variabili ad essi correlate: AHI è correlato perché la definizione di Osas si basa su questo. Quindi abbiamo dovuto vedere le variabili relative ad AHI a T1. La curva roc è stata utilizzata per trovare il cut-off. È stato identificato e vi è una capacità e specificità discriminatoria. Sicuramente AHI è un fattore di rischio ma abbiamo tanta variabilità quindi abbiamo una limitazione nell’accuratezza della valutazione del valore di Or e questo si riflette nella tabella delle previsioni in cui tutto sommato i pazienti avevano una pari età media, avevano molte cose identiche, al massimo una comorbidità presente. In sintesi, le variabili non incidono sull’andamento; rimane un’ampia quota di imponderabilità. Non c’è nulla che sistematicamente (secondo le statistiche) possa spiegare gli errori. È successo qualcosa che ha cambiato il corso, ma questo qualcosa non è spiegato da nessuna delle variabili considerate.
In aggiunta, i dati mostrano che il 16% dei pazienti Osas non trattati ha sviluppato l’infezione da Covid. È interessante chiedersi se la percentuale di pazienti Osas che hanno assunto il Covid sia compatibile con la distribuzione della popolazione generale. Quindi, Osas è un fattore di rischio? In Veneto i malati di Covid sono stati 426 su 5584: il 7% della popolazione contro il 16% dei malati di Osas nel mese di febbraio 2021.
CONCLUSIONI
Le variabili osservate nello studio longitudinale come età, BMI, tempo supino, ore di sonno, saturazione di ossigeno, frequenza respiratoria e comorbilità al tempo T0 e T1 non erano statisticamente significative riferendosi all’evoluzione dell’Osa nell’infezione da Covid. Le comorbilità non influenzano l’andamento dell’Osas. Le percentuali tra infezione da Covid nella popolazione veneta e infezione da Covid nei pazienti Osas non trattati sono significativamente differenti. È importante sottolineare che la bassa numerosità campionaria è il limite di questo studio. Tale limite è causato dal fatto che i pazienti Osas non trattati nel laboratorio del sonno sono pochissimi. Tuttavia, questi dati suggeriscono qualcosa e i dati raccolti dall’Ospedale Pederzoli sulla popolazione generale del Veneto che ha sviluppato l’infezione da Covid nel Febbraio 2021 mostrano che erano il 7% contro il 16% della popolazione Osas non trattata. Tutta la raccolta dei dati sui pazienti Osas è contemporanea alla raccolta dei dati della popolazione generale del Veneto. La sindrome delle apnee notturne è un fattore di rischio per l’infezione da Covid. La maggior parte dei dati in letteratura parla di Osas come fattore prognostico negativo in termini di ospedalizzazione dei pazienti Covid, alcuni di loro parlano di Osas come fattore di rischio per Covid. Nessuno di loro riferisce come è stata fatta la diagnosi di Osas, nè la valutazione dello studio del sonno e se i pazienti Osas ricoverati per Covid erano o meno in trattamento e qual è la compliance alla terapia; perché c’è una grande differenza tra un paziente Osas trattato e un paziente Osas trattato con una bassa compliance; quest’ultimo è come un paziente Osas non trattato!
I punti di forza di questo studio sono:
• Appropriatezza del poligrafo utilizzato per lo studio del sonno
• Analisi corretta dello studio del sonno (scoring manuale)
I limiti si riferiscono ad un periodo di valutazione limitato tra T0 e T1, una difficoltà in una maggiore raccolta dei dati dovuto al periodo pandemico, una bassa numerosità campionaria, una scarsa conoscenza della durata delle conseguenze del Covid e il fatto che i pazienti Osas non trattati erano pochi (se un numero maggiore di pazienti Osas avesse rifiutato il trattamento avremmo avuto un confronto più attendibile con il gruppo dei pazienti in terapia).
Francesca Francese
Giuliana Conte
Mario Ermani
Autori
Francesca Francese gestisce l’Ambulatorio del Sonno presso l’Ospedale Pederzoli di Peschiera del Garda. Si occupa della diagnosi e del trattamento della sindrome delle apnee notturne seguendo il paziente affetto da Osas in tutto il suo percorso. Collabora con la Direzione Sanitaria e il Centro Unico Prenotazioni per la gestione delle agende al fine di offrire il percorso di cura più adeguato e con le dovute tempistiche.
Giuliana Conte insegna Inglese Scientifico e Linguistica presso l’Università degli Studi di Padova. E’ specializzata in linguaggi tecnico scientifici e teoria della traduzione scientifica. Collabora anche con le Aziende Sanitarie Locali dove insegna Inglese per l’area medica. Ha al suo attivo diverse pubblicazioni relative all’analisi e stesura di testi scientifici in lingua.
Mario Ermani è ricercatore nel Dipartimento di Neuroscienze dell’Università di Padova. Insegna Neurofisiopatologia e Statistica nello stesso Dipartimento. Svolge attività di analisi statistica su dati clinici e sperimentali, relativi a vari argomenti, come l’epilessia, lo stroke, le malattie degenerative, i tumori cerebrali, l’analisi di sorgente dell’attività corticale, la connettività cerebrale. E’ autore/coautore di 241 pubblicazioni.
Bibliografia
Guan WJ, Ni ZY, Hu Y, et al.; for the China Medical Treatment Expert Group for Covid-19. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med 2020;382:1708-20. (1)
Gupta MA et al Obstructive Sleep Apnea and Psychiatric Disorders: A Systematic Review J Clin Sleep Med 2015;11(2):165–75 (2)
Himanshu Wickramasinghe, Obstructive Sleep Apnea (OSAS) MD, MBBS; Chief Editor: Zab Mosenifar, MD, FACP, FCCP Updated: Sep 15, 2020 (3)
Hou H et al Association of obstructive sleep apnea with hypertension: A systematic review and meta-analysis. J Glob Health. 2018 Jun 8(1):010405e. (4)
Leila Kheirandish-Gozal and David Gozal Obstructive Sleep Apnea and Inflammation: Proof of Concept Based on Two Illustrative Cytokines Int J Mol Sci. 2019 Feb; 20(3): 459. Published online 2019 Jan 22. doi: 10.3390/ijms20030459 (5)
Lombardi C et al Systemic hypertension in obstructive sleep apnea J Thorac Dis. 2018 Dec; 10(Suppl 34): S4231–S4243. (6)
Patil SP et al Treatment of Adult Obstructive Sleep Apnea With Positive Airway Pressure: An American Academy of Sleep Medicine Systematic Review, Meta-Analysis, and GRADE Assessment. J Clin Sleep Med, 2019 (7)
Reutrakul S et al Obstructive Sleep Apnea and Diabetes : a State of the Art Review Chest 2017;152(5)1070-1086 (8)
Richardson S, Hirsch JS, Narasimhan M, et al.; and the Northwell COVID-19 Research Consortium. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA 2020;323:2052-9. (9)
Tietjens JR. Obstructive Sleep Apnea in Cardiovascular Disease: A Review of the Literature and Proposed Multidisciplinary Clinical Management Strategy J Am Heart Assoc.2019;8:8(1) e010440. doi: 10.1161/JAHA.118.010440. (10)




