da Leadership Medica n. 3 del 2003
Sommario
- Introduzione
- Il trapianto di Midollo Osseo e l’ASCT
- Le malattie autoimmuni casuali e l’ASCT
- Le patologie delle articolazioni e del tessuto connettivo e l’ASCT
- Sclerosi sistemica
- L’Artrite Reumatoide
- L’artrite idiopatica giovanile
- Lupus Eritematoso Sistemico
- Citopenie refrattarie autoimmuni
- Conclusione
- Bibliografia
Introduzione
Oggi le malattie reumatiche (RD) rappresentano un problema per i sistemi di sicurezza sociale di tutto il mondo. Hanno costi di gestione enormi a causa della cronicità delle malattie stesse. La qualità della vita è di certo povera, la perdita dell’impiego è alta e l’esito a lungo termine è poco soddisfacente, nonostante una risposta iniziale positiva alle terapie immunomodulatorie (cfr.). Per questo motivo le nuove terapie razionali vengono in particolar modo autorizzate per fermare l’evoluzione della patologia evitando il deteriorarsi delle articolazioni e degli organi interni. Il trapianto di cellule staminali autologhe (ASCT) in seguito ad una chemioterapia ablativa ad alto dosaggio è oggi diventato una realtà all’interno di un programma di studio internazionale. Il dosaggio di farmaci come il ciclofosfamide (Cy) è significativamente limitato a causa dei loro effetti collaterali e in particolare della loro tossicità per il midollo osseo. Per questo motivo si è elaborato un progetto internazionale per superare quel limite e salvare i pazienti mediante l’ASCT. Tale studio venne sviluppato secondo linee guida decise all’unanimità e tali che attualmente circa 600 pazienti hanno ricevuto un ASCT soprattutto nel contesto degli studi di fase I/II (cfr. Gerber, Gratwohl, Passegg, Tyndall, Best Clin Haematol 2002). Circa 450 di questi casi sono stati registrati dalla base dati dell’European Group for Blood and Marrow Transplantation (EBMT) e dell’European League Against Rheumatism ( EULAR ). Questa relazione sintetizza i risultati ottenuti dal progetto. Non ci si deve dimenticare che, in patologie come la leucemia, la sopravvivenza a lungo termine in assenza di malattia evidente è oggi possibile per molti pazienti grazie all’attenta conduzione di studi di controllo randomizzati piuttosto che alla piena comprensione della fisiopatologia. Si spera che l’ASCT, una forma di terapia intrinsecamente tossica e pericolosa, cada in disuso per le RD quando si studieranno in futuro delle nuove terapie mirate.
Il trapianto di Midollo Osseo e l’ASCT
Una delle prime relazioni su un tentativo di trapianto di midollo osseo (BMT) fu pubblicata nel 1939 (cfr.): venne effettuato su una giovane donna con sospetta anemia aplastica indotta da sali d’oro, essendo l’oro stato somministrato per curare una tubercolosi polmonare. E’ interessante come una delle prime relazioni sul BMT, che per pura coincidenza aveva indotto la remissione di una AD, fosse su un paziente affetto da anemia aplastica provocata dalla terapia basata sull’oro e adottata contro l’artrite reumatoide.(cfr). Nell’ultimo decennio si sono eseguiti molti trapianti di cellule staminali ematopoietiche prelevate perifericamente (HSC) e un minor numero di trapianti di midollo osseo e, di recente, anche pochi prelievi di HCS dal sangue del cordone ombelicale (tabella 1 – EBMT file gigante).
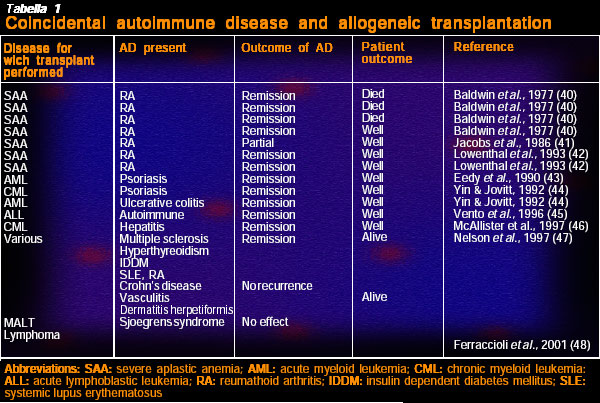
Dalla prospettiva terapeutica per le AD, esistono significative differenze fra una fonte periferica e le HSC del midollo osseo.
Il midollo osseo contiene meno cellule T ma richiede un intervento sotto anestesia generale e un tempo di ricostituzione più lungo a causa della presenza di poche cellule progenitrici. Nei bambini piccoli affetti dall’artrite idiopatica giovanile non è talvolta possibile mobilizzare cellule staminali in numero sufficiente per un prelievo periferico: è risaputo che sono necessari almeno 2 X 10 6 CD34 cellule positive (cellule staminali e progenitrici) per kg di peso corporeo per assicurare una ricostituzione ematologica affidabile. D’altro canto una fonte periferica di HSC necessita della mobilitazione di cellule staminali dal midollo osseo mediante la somministrazione di alte dosi di Cy e/o di fattori di crescita, soprattutto il G-CSF. Questo presenta nuove prospettive per i pazienti colpiti dalle AD.
I primi tentativi di mobilizzare le cellule staminali non ebbero successo in 5 pazienti probabilmente a causa di precedenti trattamenti tossici per il midollo. Tale risultato non fu così comune come si era anticipato inizialmente (cfr.) e venne superato unendo al materiale del trapianto una seconda mobilitazione od optando per un prelievo di midollo osseo. Inoltre il G-CSF può potenzialmente scatenare un episodio di AD e questo si osservò in alcuni pazienti, soprattutto RA (8/72) (cfr.). La maggior parte di questi episodi fu relativamente facile da controllare, ma in almeno uno di loro (sclerosi multipla) l’esito fu fatale (cfr.). In certi casi dosaggi di 2-4 gms/m2 di Cy somministrati per la mobilitazione portarono ad un rapido miglioramento delle AD tale che questo metodo venne adottato in fase di pre-randomizzazione negli studi di fase III per RA e SLE (vedi sotto). Si è discusso a lungo sul bisogno di purgare intensamente dai linfociti autoaggressivi il materiale da trapiantare, come pure sul concetto che solo un omotrapianto potesse sostituire un sistema immunitario difettoso o “curare” le AD attraverso un trapianto teorico contro una reazione cellulare autoimmune. Cinque anni e 600 pazienti più tardi è ragionevole dire che i regimi più aggressivi, come l’irraggiamento o quelli basati sul busulfan/ciclofosfamide, erano associati ad una maggior tossicità e solo ad una tendenza verso una remissione duratura (cfr.). Per quanto riguarda il purgare, si notò di nuovo un’associazione fra l’intensità della purga e il rischio d’infezione, senza però alcun vantaggio evidente. E’ risaputo che con la chemioterapia o l’irraggiamento non è possibile effettuare una completa purga cellulare sia in vivo sia in vitro per cui al massimo si ha un “debulking” autoimmune con l’ASCT. Certi gruppi non manipolarono il materiale da trapiantare e uno studio (cfr.) randomizzò i pazienti RA con CD34 con quelli senza, e non si osservò alcun vantaggio in termini di ricaduta (cfr.); in realtà si notò una minor tendenza verso le ricadute nel gruppo non purgato (cfr.), presentando quindi la questione di modulare le cellule T (precedentemente chiamate cellule suppressor) che servono per controllare il processo autoreattivo. Nell’insieme si è sviluppato con questo progetto il concetto di riorganizzare la reazione autoimmune piuttosto di rimuoverla inducendo la tolleranza, come suggerirono esperimenti su modelli animali.
Le malattie autoimmuni casuali e l’ASCT
Sono state pubblicate molte cartelle cliniche retrospettive, alcune prognostiche e molte collane (cfr.) a partire dalle prime relazioni sui miglioramenti e persino sulle remissioni a lungo termine di RA in seguito all’ASCT (cfr.). Le prime relazioni sui casi di ASCT furono seguite da benefici a lungo e breve termine dopo l’auto ASCT (tabella 2).
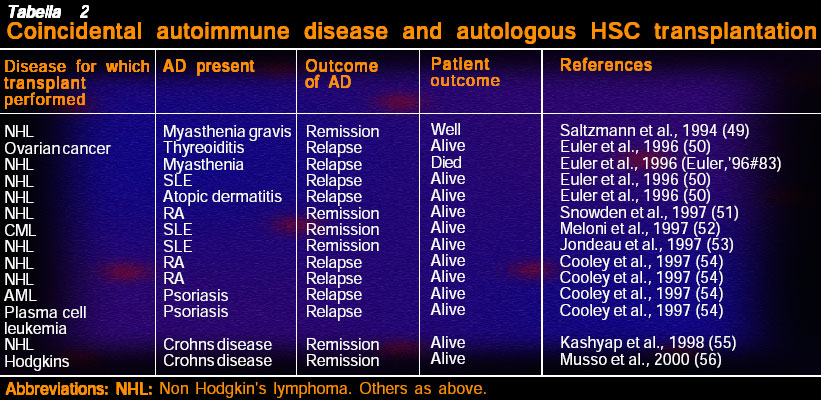
Pur essendo di grande interesse, queste cartelle cliniche hanno lo svantaggio del taglio dato per la pubblicazione e dei dettagli incompleti riguardo allo stato delle AD e l’entità dell’esito. Di recente si sono pubblicati casi di risposte negative o dell’assenza di esse (cfr.), ed è stato constatato che le AD possono essere passivamente trasmesse attraverso l’ASCT. Tuttavia si sono fatti degli importanti commenti su queste cartelle cliniche. Una donna affetta da RA che ricevette un omo-ASCT dal fratello sano per curare un’anemia aplastica indotta da sali d’oro godette di una remissione clinica e sierologica di 4 anni del RA seguita da una ricaduta completa. Tutte le cellule immunocompetenti prelevate dal sangue e dalle articolazioni erano di tipo donor (contenenti il cromosoma Y), dimostrando quindi la complessità della fisiopatologia delle AD. In un altro caso un uomo colpito dalla leucemia ricevette un omo-ASCT dal fratello che aveva un HLA identico ma uno SLE inattivo (cfr.). Il donatore aveva anticorpi contro C1q, che si manifestò più tardi per poi scomparire senza segni renali o altre manifestazioni SLE nell’ospite dopo il trapianto. Entrambi questi casi dimostrano che l’ambiente ospite/rete di modulazione cellulare gioca un ruolo tanto essenziale nell’espressione finale delle AD quanto i cloni stimolanti le cellule autoreattive.
Le patologie delle articolazioni e del tessuto connettivo e l’ASCT
Il progetto combinato dell’EBMT e dell’EULAR per le patologie autoimmuni rilasciò linee guida decise all’unanimità (cfr.) prima che il primo paziente venisse trattato e si formò subito una collaborazione con l’America del Nord e il Registro Internazionale di Trapianti di Midollo Osseo (IBMTR). Simili gruppi di dati su pazienti trapiantati sono raccolti in tutto il mondo: quelli delle Americhe si trovano nell’IBMTR e quelli del resto del mondo nella base dati dell’EBMT/EULAR a Basilea. La base dati EBMT/EULAR contiene informazioni su 450 registrazioni, essendo le malattie più comunemente trapiantate sclerosi sistemica (SSc), RA , JIA e SLE (tabella 3).
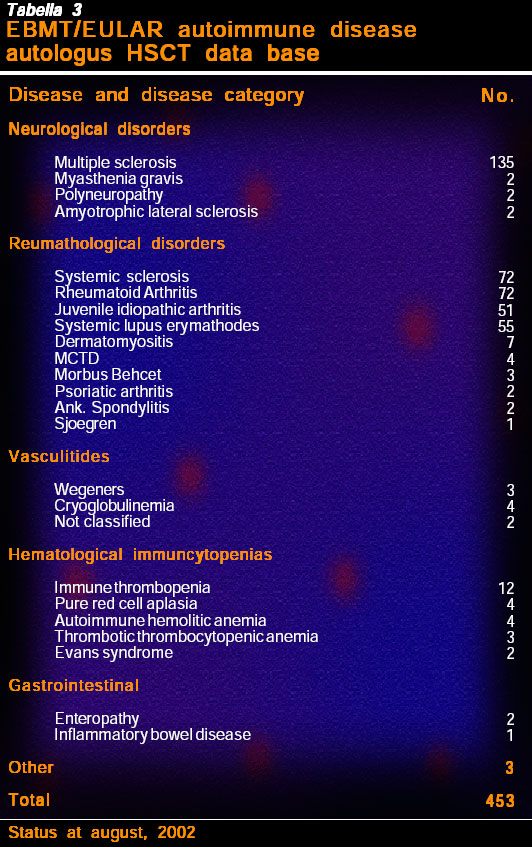
I dati provengono da 82 centri di trapianto in 21 paesi e la mortalità iniziale da trapianto (TRM) era del 7% (cfr.). Questa era più alta dello stimato 3% per gli auto-ASCT totali, riflettendo il malessere generale dei pazienti e il coinvolgimento di più organi di molti pazienti con RD rispetto a, diciamo, pazienti col carcinoma mammario sottoposti ad alte dosi chemioterapiche e all’ASCT. C’era infatti una marcata differenza fra i gruppi AD aventi un TRM di 12,5% in SSc e solo un paziente con RA. Furono pure diversi il tasso e il tipo di risposta. Più pazienti RA, JIA e SLE risposero subito per poi ricadere rispetto a quelli SSc.
Sclerosi sistemica
Fra i primi 45 pazienti, si notò un miglioramento del 25% o più nel 70% di essi, con un TRM del 17%. (15). Furono usati vari protocolli, basati soprattutto sul Cy (una mobilitazione di 4g/m2 di Cy e condizionamento di 200 mg di Cy/kg peso corporeo) o sull’irraggiamento di 8 Gy/Cy per 120mg/kg di peso corporeo. Aumentando il numero di pazienti presi in considerazione, il TRM scese a 8,6%, un calo che si pensò dipendesse da una più attenta selezione dei pazienti stessi. La funzionalità polmonare tendeva a stabilizzarsi e alcuni fattori furono identificati come potenzialmente rischiosi per l’ASCT, per es. l’ipertensione polmonare con una pressione arteriosa polmonare media superiore a 50mmHg, un intenso coinvolgimento cardiaco, un’acuta fibrosi polmonare e un’ipertensione sistemica non controllata. Quando questi pazienti furono esclusi dall’analisi, il TRM scese al 7%, suggerendo che lo studio randomizzato controllato proposto sarebbe stato eticamente accettabile, considerando una mortalità di quasi 50% in 5 anni in questo sottogruppo di pazienti. Nel nuovo protocollo dello studio, lo studio ASTIS (Autologous Stemcell Transplantation International Scleroderma), sono stati esaminati solo pazienti con diffusa SSc epidermica aventi un esteso coinvolgimento cutaneo da meno di 4 anni e segni evidenti di una malattia progressiva che minacciava gli organi o la vita stessa. Lo scopo primario di questo studio è raggiungere una sopravvivenza libera da eventi dopo 2 anni. Il braccio trattato viene mobilitato con Cy 4g/m2 e G-CSF, seguito da un condizionamento con Cy 200mg/kg di peso corporeo più ATG e un innesto selezionato di CD 34. Al braccio di controllo viene mensilmente somministrato endovena CY 750mg/m2 per 12 mesi. Ciascun braccio conta 100 pazienti. L’ASTIS è tuttora in corso e finora, seguendo questi criteri di selezione, non ci sono stati decessi dovuti al trapianto. Per ulteriori informazioni visitate il sito: http://www.astistrial.com o inviate un messaggio e-mail all’indirizzo: Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo. .
L’Artrite Reumatoide
Dei 63 pazienti che subirono un trapianto, l’analisi dei primi 72 dimostrò un miglioramento significativo: il 78% di essi riusciva ad avere una risposta ACR 50. Questa è una misura combinata dei parametri clinici e di laboratorio che dovrebbe migliorare di almeno il 50%. Prima del trapianto la maggior parte dei pazienti non riusciva a rispondere ad almeno 3 tradizionali farmaci antireumatici che modificano la malattia (DMARD), come il metotrexato o la sulfasalazina. Si notarono ricadute di una certa entità nel 73% di pazienti dopo il trapianto, ma fu relativamente facile controllarle in molti di essi mediante l’uso di farmaci che si erano dimostrati inefficaci prima del trapianto. Il controllo medio avvenne dopo 18 (6-40) mesi e la maggior parte dei pazienti ricevette solo un regime di condizionamento di Cy 200mg/m2, mentre invece ricevette un ugual numero di cellule staminali prelevate perifericamente dopo la mobilitazione G-CSF o Cy/ G-CSF. Queste esperienze di fase I e II furono integrate in uno studio randomizzato di fase III, lo studio ASTIRA (Autologous Stemcell Transplantation International Rheumatoid Arthritis). Lo studio arruola solo pazienti con RA attiva che non hanno risposto ad almeno 4 DMARDS (compreso il metotrexato e l’anti-TNF alpha) in seguito ad una malattia della durata di 2-15 anni. Una volta mobilitate le cellule staminali con il Cy 4g/m2 e il G-CSF, si passa alla randomizzazione o verso la terapia tradizionale continuativa con il metotrexato o il leflunamide o verso il condizionamento mediante la somministrazione di Cy 200 mg/m2 e ATG. Il materiale trapiantato non viene manipolato e si somministra una terapia di mantenimento con il metotrexato o il leflunamide. Lo scopo primario è il numero di pazienti che raggiunge una buona o moderata risposta EULAR o ACR 20 a sei mesi. Ciascun braccio deve essere formato da 16 pazienti, calcolati su una differenza di > 50% fra i due gruppi. Per ulteriori dettagli visitate il sito http://www.EBMT.org o inviate un messaggio e-mail all’indirizzo: Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
L’artrite idiopatica giovanile
Si è registrato un totale di 51 bambini affetti dall’artrite idiopatica giovanile, soprattutto nella forma sistemica chiamata malattia di Still. La maggior parte di questi casi furono trattati in due centri olandesi usando una fonte di cellule staminali prelevata dal midollo osseo e un protocollo di condizionamento comprendente Cy 200mg/kg di peso corporeo, TBI 4Gy e ATG (N Wulffraat, comunicazione personale). Nell’intero gruppo si riferirono 15 remissioni complete e 3 remissioni parziali. Si poté ridurre il dosaggio di corticosteroidi in quelli che avevano raggiunto la remissione e alcuni pazienti passarono alla pubertà e sperimentarono una crescita di compensazione. Tre pazienti morirono della sindrome di attivazione macrofagica, che si pensò fosse legata ad un’infezione ricorrente o ad un’attività sistemica incontrollata della patologia stessa al momento del trapianto. I protocolli furono modificati in modo che l’attività sistemica venisse controllata prima del trapianto con il metilprednisolone somministrato endovena. Dopo queste modifiche non si verificarono altri decessi simili. Si condurranno altri studi pilota delle fasi I e II prima di proporre lo studio randomizzato ottimale di fase III.
Lupus Eritematoso Sistemico
Dei 55 registrati, la maggior parte presentava un coinvolgimento renale e/o CNS, e 21 non aveva risposto alla terapia tradizionale con il Cy. Nella maggior parte dei casi si usò una fonte di cellule staminali periferiche dopo la mobilitazione con il Cy e il G-CSF. Ventitré pazienti furono condizionati con Cy e ATG, undici con Cy e TBI e si usarono anche cinque altri regimi. Ci furono 5 decessi causati dalla terapia e uno dal progresso della patologia, risultante in un TRM di 10 calcolato statisticamente (2-20 %). In quei pazienti che presentavano dati sufficienti per l’analisi, il 72% raggiunse una remissione, definita SLEDAI (Indice dell’attività del lupus eritematoso sistemico) La chemioterapia ad alto dosaggio comprendeva ciclofosfamide 200mg/kg, metilprednisolone 1 gm e ATG equino 90mg/kg. I pazienti idonei presentavano una glomerulonefrite di classe WHO III-IV; un’encefalite da lupus; una mielite trasversa; una vasculite da lupus, che coinvolgeva il cuore o il parenchima polmonare - nessuno di questi ultimi aveva risposto ad almeno sei cicli di ciclofosfamide somministrato endovena; citopenie acute, perisolose per la vita e associate al lupus, che non rispondevano alle dosi standard di ciclofosfamide; o la catastrofica sindrome antifosfolipidica.
Dei 7 pazienti, 2 furono segnalati per lo studio a causa della presenza di patologie polmonari progressive e ipossia a riposo, ma non erano ventilatore dipendenti. Un paziente con emorragia alveolare era ossigeno dipendente e necessitava del sostegno intermittente del ventilatore. Quattro avevano una glomerulonefrite di classe WHO III-IV e la sindrome nefrosica. Cinque avevano un clearance della creatina al di sotto della norma. Tutti soffrivano d’ipertensione incontrollata che richiedeva l’uso di quattro agenti anti-ipertensivi. Due soffrivano di ipocinesi miocardica. Due ebbero delle convulsioni poco prima del trapianto.
Citopenie refrattarie autoimmuni
Le citopenie refrattarie rappresentano un gruppo estremamente eterogeneo. I meccanismi sembrano essere più chiaramente definiti con anticorpi putativi diretti contro gli epitopi presenti in una o più linee cellulari ematopoietiche. Le risposte soddisfacenti furono pubblicate molto presto, ci furono pochi pazienti con ITP, presto seguiti da insuccessi. La base dati comprende un totale di nove pazienti, due dei quali presentavano una remissione totale. La più grande serie di 14 pazienti con ITP viene dal NIH (cfr.). Tutti soffrivano di ITP refrattaria acuta che non rispondeva ad almeno tre regimi terapeutici e tutti erano stati splenectomizzati. Otto mostrarono una chiara risposta e sei una remissione totale prolungata per oltre due anni.
Nessuno morì di complicanze da trapianto. Il condizionamento venne effettuato con il Cy e tutti i 16 ricevettero un trapianto selezionato di CD34. Gli altri pazienti colpiti da citopenie erano eterogenei: aplasia eritrocitaria pura (nr. 4), anemia emolitica autoimmune (nr. 2) e la Sindrome di Evans (nr.1).
L’età media era 31 (4-45) anni e il tempo medio per il trapianto era di 93 mesi (12-236). Molti ricevettero cellule staminali dal sangue mobilitato con fattori di crescita (nr. 7) o con il Cy assieme a fattori di crescita (nr. 6). Ci furono due prelievi di midollo osseo. I regimi di condizionamento comprendevano solo Cy (nr. 3), Cy assieme ad altri farmaci o all’ATG (nr. 9), melfalan (nr. 2) o erano basati sulla fludarabina.(nr. 2). Nella maggior parte dei casi (nr. 12) il materiale da trapiantare venne purgato delle cellule immuni.

Conclusione
L’analisi dei risultati dell’ASCT nelle RD sostiene una nuova possibilità ed è uno strumento che potremmo avere per interferire con l’evoluzione della patologia. Nuovi studi stanno ora indagando sugli effetti dell’ASCT nelle RD. La speranza di molti ricercatori è ora focalizzata sui risultati di queste prove per affermare definitivamente che l’ASCT è untrattamento efficace. I dati delle fasi I e II suggeriscono che per alcuni pazienti AD attentamente scelti, l’ASCT potrebbe offrire una terapia alternativa con un rapporto rischio/beneficio eticamente accettabile. Tuttavia sarà solo attraverso studi multicentrici internazionali randomizzati che questa possibilità potrà essere supportata da prove. Il lavoro duro inizia ora.
Alan Tyndall
Dipartimento di Reumatologia Università di Basilea Svizzera
Marco Matucci Cerinic
Dipartimento di Medicina Sezione di Reumatologia Università di Firenze Italia Tradotto da Interpres sas
Tyndall A, Koike T: High dose immunoablative therapy with hematopoietic stem cell support in the treatment of severe autoimmune disease – Current status and future directions. Intern Med 41: 608-612, 2002
Tyndall A, on behalf of the European group for Blood and Marrow Transplantation (EBMT) and the European League Against Rheumatism (EULAR). Haematopoietic stem cell transplantation in the treatment of severe autoimmune disease – Current status and future directions. ESCISIT Newsletter Vol 2: 9-10, 2002.
Frey D, Tyndall A.: Reaktive Arthritiden – was gibt es Neues ? Schweiz. Med. Forum 24: 577-580, 2002
Gratwohl A, Passweg J, Kühne T, Tyndall A, Holzgreve W, Skoda R, Marbet G,Tichelli A. Hämatopoietische Stammzelltransplantation. Schweiz. Med Forum 25: 597-606, 2002
Fassas A, Passweg JR, Anagnostopoulos A, Kazis A, Kozak T, et al.. For the Autoimmune Disease Working Party of the EBMT. Hematopoietic stem cell transplantation for MS: a retrospective multicentre study. Journal of Neurology, 249 (8): 1088-1097, 2002
Tyndall A, Gratwohl A. The use of high dose immunoablative therapy withhematopoietic stem cell support therapy in the treatment of severe autoimmune diseases. Int J Hematol 76 (Suppl. 1): 218-222, 2002
Krieg MA, Cornuz J, Ruffieux C, Sandini L, Büche D, Dambacher MA, Hartl F,et al.: Ability of three bone ultrasounds to discriminate subjects with and without osteoporotic fractures among 7562 elderly women. J Bone Miner Res (in press, 2002)
Kroesen S, Widmer A, Tyndall A, Hasler P. Serious bacterial infections in patients with rheumatoid arthritis under anti-TFN-a therapy.Rheumatology (accepted, 2002)
1. A Pignone, Scaletti C, Matucci Cerinic M, Vazquez-Abad D, Del Papa N, Meroni PL, Generini S, Calzolari A, Rothfield N, Cagnoni M: Antiendothelial cell antibodies in systemic sclerosis: correlation with vascular involvement Clin Exp Rheumatol 572,16,1998
2. JW Xu, Konttinen YT, Li TF, Waris V, Lassus J, Matucci Cerinic M, Sorsa T, Santavirta S: Production of PDGF in aseptic loosening of total hip eplacement. Rheumatol Int 215,17,1998
3. F Falcini, De Simone L, Donzelli L, Matucci Cerinic M: Congenital conduction defects in children born to asymptomatic mothers with anti-SSA/SSB antibodies: report of two cases. Ann It Med Int 169,13,1998
4. Ceponis A, Konttinen YT, Takagi M, Xu JW, Sorsa T, Matucci Cerinic M, Santavirta S, Bankl HC, Valent P: Expression of stem cell factor and SCF receptor (c-kit) in synovial membrane in arthritis: correlation with synovial mast cell hyperplasia and inflammation. J Rheumatol 25,2304,1998
5. M Matucci Cerinic, Generini S, Pignone A, Cagnoni M: From Raynaud’s phenomenon to systemic sclerosis: lack or exhaustion of adaptation ? Adv Org Biol 241,6,1998
6. Matucci Cerinic M, Casale R, Del Rosso A, Generini S, Pignone A, Cagnoni M: Le complicanze neurologiche in corso di sclerosi sistemica. Ital J Neurosci 1998 s235, 19,1998
7. M Matucci Cerinic, Iannone F, Carossino AM, Pignone A, Leoncini G, Generini S, Lapadula G, Cagnoni M: Dyscrepant expression of neprilysin on fibroblasts in diffuse systemic sclerosis. J Rheumatol 347, 26,1999
8. F Falcini , Lombardi A, Generini S, Pignone A,Cimaz R, Partsch G, Ermini M, M Matucci Cerinic: Are angiotensin converting enzyme and von Willebrand factor circulating levels useful surrogate parameters to monitor disease activity in Kawasaki disease ? Endothelium 209,6,1999
9. R Cimaz, Matucci Cerinic M, Zulian F, Falcini F: Reflex sympathetic dystrophy in children. J Child Neurol 363,14,1999
10. G Simonini, Matucci Cerinic M, Generini S, Zoppi M, Anichini M, Cesaretti A, Pignone A, Falcini F; Lotti T, Cagnoni M. Oxidative stress in systemic sclerosis Mol Cell Biochem 185,196,1999
11. M Del Rosso, Fibbi G, Matucci Cerinic M: The urokinase-type plasminogen activator system and inflammatory joint diseases. Clin Exp Rheumatol 485 ,17,1999
12. S Knupp-Oliveira, Matucci Cerinic M: Polyneuropathy as initial manifestation of systemic sclerosis. Scand J Rheumatol 260,28,1999
13. F Falcini, Azzari C, Gelli MG, Ermini M, Luchetti M, Gabrielli A, Calzolari A, Pignone A, Generini S, Matucci Cerinic M: Reduction of bcl-2 in T cells during immunosuppressive therapy in patients with severe juvenile onset systemic lupus erythematosus. Clin Immunol 59 ,93,1999
14. M Matucci Cerinic, G Fiori, S Generini, Systemic sclerosis: a clinical overview. Adv Exp Med Biol 73,455.1999
15. A Del Rosso, Generini S, Pignone A, Matucci Cerinic M: Vasculitides in internal medicine. Clinics Dermatol 533, 171,1999
16. Sergio Generini, Marco Matucci Cerinic: Raynaud’s phenomenon and vascular disease in systemic sclerosis. Adv Exp Med Biol 93,455,1999
17. A Del Rosso, Generini S, Casale R, Zoppi M, Matucci Cerinic M: Neurogenic inflammattion and joint diseases. On line Rheumatology Archives1999
18. E Witort Serraglini, Del Rosso M, Lotti T, Matucci Cerinic M: Endothelial injury in vasculitides Clinics Dermatol 587,171,1999
19. M Matucci Cerinic, Pignone A, Generini S, Korn J: May fibroblasts determine the late different fate of systemic sclerosis and primary hypertrophic osteoarthropathy ? Clin Exp Rheumatol 1,18,2000
20. F Falcini, Calzolari A, Pignone A, Ermini ME, Scaletti C, Zulian F, Generini S, Simonini G, Matucci Cerinic M: Bcl-2,p53 and c-myc expression in juvenile dermatomyositis. Clin Exp Rheumatol 643,18,2000
21. G Simonini G,Generini S, Pignone A, Falcini F, Matucci Cerinic M: Diene conjugates and antibodies against oxidised low density lipoproteins in systemic sclerosis. Eur J Int Med 2000;11:289
22. M Tuveri, Generini S, Matucci Cerinic M, Aloe L: Nerve growth factor a useful tool in the treatment of chronic vasculitic ulcers in rheumatoid arthritis. Lancet 2000;356:1739
24. A Del Rosso, Righi A, Casale R Generini S, Pignone A, Busciglio J, Pelsman A, Rothfield N, Conforti ML, Cagnoni M, Matucci Cerinic M; Anticorpi antineurone nella sclerosi sistemica. Reumatismo 2000;52:210
25. Simonini S, Pignone A, Generini S, Falcini F, Matucci Cerinic M: Emerging potentials for an antioxidant therapy as a new approach to the treatment of systemic sclerosis. Toxicology 2000;155:1
26. M Matucci Cerinic, Fiori G, Pignone A: La disabilità da patologia muscoloscheletrica nell’anziano: trials clinici. G Ital Geriatria e Gerontologia 2000;48:572
27. G Simonini, Matucci Cerinic M, Cimaz R, Anichini A, Cesaretti S, Zoppi M, Falcini F: Evidence for immune activation against oxidised lipoproteins in inactive phase of juvenile chronic arthritis J Rheumatol 2001;28:198
28. Herrick A, Matucci Cerinic M: The emerging problem of oxidative stress and the role of antioxidants in systemic sclerosis Clin Exp Rheumatol 2001;19:1
29. R Livi, Teghini L, Generini S, Matucci Cerinic M: The loss of endothelial dependent control in systemic sclerosis. Chest 2001;119:672
30. M Matucci Cerinic, Giacomelli R, Pignone , Cagnoni ML, Generini S, Casale R, Cipriani P, Del Rosso A, Tirassa P, Konttinen Y, Kahaleh MB, Pan-Sheng F, Paoletti M, Marchesi C, Cagnoni M, Aloe L: Nerve growth factor and neuropeptides circulating levels in systemic sclerosis Ann Rheum Dis 2001;60:487
31. Djouadi K, Nedelec B, Tamouza R, Genin E, Ramasawmy R, Charron D, Delpech M, Laoussadi S, and the contributing EUROAS (Matucci Cerinic M): Interleukin 1 genes cluster polymorphisms in multiplex families with spondylarthropathies. Cytokines 2001;13:98
32. G Valentini, Della Rossa A, Bombardieri S, Bencivelli W, Matucci Cerinic M and the European Scleroderma Study Group: Disease activity in systemic sclerosis. II. Identification of disease activity variables and development of preliminary criteria indexes Ann Rheum Dis 2001;60:592
33. Generini, Matucci Cerinic M, Partsch G, Stancikova M, Pignone A, Konttinen YT, Rovensky J, Baker DJ, Schumacher HR jr: Evidence for hyaluronan production in the air pouch model in rats. Clin Exp Rheumatol 2001;19:271
34. A Della Rossa, Valentini G, Bombardieri S, Bencivelli W, Matucci Cerinic M and the European Scleroderma Study Group: European multicentre study for defining the disease activity criteria of systemic sclerosis . A descriptive analysis of 318 european scleroderma patients. Ann Rheum Dis 2001; 60:585
35. A Del Rosso , Pignone A, Giacomelli R, Matucci Cerinic M: Familial scleroderma: Do environmental factors, genes and microchimerism share the same relevance ? J Eur Acad Dermatol 2001;15:11
36. A Pignone, Generini S, Matucci Cerinic M: PGE1 restores the levels of vWF and ACE in chronic critical limb ischemia in systemic sclerosis. Clin Exp Rheumatol 2001;19:358
37. O Kowal-Bielecka, Distler O, Neidhart M, Künzler P, Rethage J, Nawrath M, Carossino A, Pap T, Muller Ladner U, Michel BA, Sierakowski S, Matucci-Cerinic M, Gay R, Gay S: Evidence for 5-lipoxygenase overexpression in the skin of patients with systemic sclerosis. A new pathway to skin inflammation Arthritis Reum 2001;44:1865
38. R Giacomelli, Cipriani P, Fulminis A, Barattelli G, Matucci Cerinic M, D’Alò S, Cifone G, Tonietti G: Circulating g/d T lymphocytes of systemic sclerosis patients dysplay a T helper Th1 polarization. Clin Exp Immunol 2001;125,310
39. P Sambo, Amico D, Giacomelli R, Matucci Cerinic M, Salsano F, Valentini G, Gabrielli A: Intravenous N-acetylcysteine for the treatment of Raynaud’s phenomenon secondary to systemic sclerosis: A pilot study J Rheumatol 2001;28.2257
40. O Distler, Pap T, Kowal-Bielecka O, Meyringer R, Guiducci S, Landthaler M, Scholmerich J, Michel B, Gay R, Matucci Cerinic M, Gay S, Muller-Ladner U: Overexpression of MCP-1 in systemic sclerosis: role of PDGF and effects of monocyte chemotaxis and collagen synthesis. Arthritis Rheum 2001;44:2665
41. M Matucci Cerinic: I coxib: una nuova via terapeutica. Celecoxib. Annali Italiani di Medicina Interna. 2001;16 (suppl 3):104s-110s
42. A Pignone, Matucci Cerinic M: Le patologie artrosiche. Pathos 2001;8 (suppl),4
43. ML Brandi, Gennari L, Matucci Cerinic M, Becherini L, Falchetti A, Gennari C, Reginster JY: Genetic markers of osteoarticular disorders: facts and hopes. Arthritis Res 2001;3:270
44. A Righi, Schiavon P, Jablonska S, Rondinone , Doria A , Todesco S, Matucci Cerinic M: Treatment of Scleromyxedema with intravenous immunoglobulins. Ann Rheum Dis 2002;61:59
45. S Guiducci, Del Rosso A, Pignone A, Generini S, Matucci Cerinic M: Il fenomeno di Raynaud nella terza età. Giornale Italiano di Gerontologia Geriatria 2002;49:285
46. R Giacomelli, G Valentini, F Salsano, Cipriani P, Sambo P, Conforti ML, Fulminis A, De Luca A, Farina G, Candela M, Generini S, De Francisci A, Tirri E, Proietti M, Bombardieri S, Gabrielli A, Matucci Cerinic M: Cyclophosphamide pulse regimen for the treatment of alveolitis in systemic sclerosis. J Rheumatol 2002;29:731
47. S Gabbrielli, Pignone A, Matucci Cerinic M: Is bronchoalveolar lavage also an interstitial lavage ? Clin Exp Rheumatol 2002;20:441
48. LIbba Manneschi, Del Rosso A, Pacini S, Bechi P, Matucci Cerinic M: The ultrastructure of the muscle coat of the gastric wall in a case of systemic sclerosis. Ann Rheum Dis 2002;61:754
49. L Bertinotti, Pietrini U, Del Rosso A, Casale R, Colangelo N, Zoppi M, Matucci Cerinic M: The use of pupillometry in joint and connective tissue diseases Ann NY Acad Sci 2002; 966:446
50. C Fatini, Gensini F, Sticchi E, Battaglini B, Angotti C, Conforti ML, Generini S, Pignone A, Abbate R, Matucci Cerinic M: High prevalence of ACE I/D and endothelial nitric oxide synthase glu298—Asp, but not of T-786—C polymorphism in systemic sclerosis. Am J Med 2002;112:540
51. R Livi, Teghini L, Pignone A, Generini S, Matucci Cerinic M, Cagnoni M: Renal functional reserve is impaired in patients with systemic sclerosis without clinical signs of kidney involvement. Ann Rheum Dis 2002;61:682
52. R Giacomelli, Cipriani P, Matucci Cerinic M, Fulminis A, Barattelli G, Pingiotti E, Di Franco M, Trotta A, Perticone R, Zazzeroni F, Alesse E, Tonietti G: Combination therapy with cyclosporine and methotrexate in patients with early rheumatoid arthritis soon inhibits TNFalfa production without decreasing TNFalfa mRNA levels. An in vivo and in vitro study. Clin Exp Rheumatol 2002;20:365
53. O Distler, del Rosso A, Giacomelli R, Cipriani P, Conforti ML, Guiducci S, Gay R, Michel BA, Brühlmann P, Müller-Ladner U, Gay S, Matucci-Cerinic M: Angiogenic and angiostatic factors in systemic sclerosis: Increased levels of vascular endothelial growth factor (VEGF) are a feature of earliest disease stages and are associated with the absence of fingertip ulcers. Arthritis Res 2002;4:r11
54. M Matucci Cerinic, Kahaleh BM: Beauty and the beast. The nitric oxide paradox in systemic sclerosis. Rheumatology 2002; 41:843-7.
55. L Bertinotti, Miniati I, Matucci Cerinic M: Angioedema and systemic sclerosis. A review of the literature. Scand J Rheumatol 2002;31,178
56. S Generini, Fiori G, Matucci Cerinic M: Therapy of spondyloarthropathy in inflammatory bowel disease. Clin Exp Rheumatol 2002;20 (suppl 28):s88
57. G Fiori, Pignone A, Matucci Cerinic M: Overlap Syndromes. Reumatizam 2002.; 9,12
58. A Righi, Matucci Cerinic M: The therapy of systemic sclerosis: the rheumatologic perspective. J Eur Acad Dermatol 2002, 16,431
59. R Giacomelli, Matucci Cerinic S, Bombardieri S: The paradigm of Microchimerism in Sjogren syndrome and other autoimmune diseases. Ann Rheum Dis 2003; 61,1039
60. Kalfin R, Righi A, Del Rosso A, Bagchi D, Das DK, Generini S, Guiducci S, Matucci Cerinic M: Activin, a grape seed derived proanthocyanidin extract, reduces oxidative stress and adhesion molecules (ICAM-1, VCAM-1 and E-selectin) plasma levels in systemic sclerosis. Free Radical Res 2002; ;36:819
61. P Failli, D’Alfonso C, Giovannelli L, Generini S, Del Rosso A, Pignone A, Stanflin N, Orsi M, Zilletti L, Matucci Cerinic M: N-acetyl cysteine reduces superoxide anion and peroxynitrite production of lung alveolar macrophages in systemic sclerosis. Nitric Oxide 2002; 7:277
62. A Pignone, Fiori G, Del Rosso A, Generini S, Matucci Cerinic M: The pathogenesis of inflammatory muscle diseases: on the cutting edge among the environment, the genetic background, the immune response and the dysregulation of apoptosis. Autoimmunity Reviews 2002; 1: 226
63. M Matucci Cerinic, Pignone A, & Giacomelli R: Microchimerismo e sclerosi sistemica. Convegno sulle malattie autoimmuni sistemiche, Firenze, 29 Settembre 2001
64. A Pignone & Matucci Cerinic M: La patogenesi della Polimiosite/Dermatomiosite. Convegno sulle malattie autoimmuni sistemiche, Firenze, 29 Settembre 2001
65. M Matucci Cerinic & Casale R: La riabilitazione della sclerosi sistemica. Congresso SIMFER/SIR sulla riabilitazione delle malattie reumatiche, Mantova, 10-14 Ottobre 2001
66. M Matucci Cerinic: I COXIB una nuova via terapeutica: Celecoxib. 102 Congresso della Società Italiana di Medicina Interna, Roma, 23-27 Ottobre 2001
67. M Matucci Cerinic: La patogenesi della sclerosi sistemica. Congresso della Società Italiana di Reumatologia, Padova, 20-24 Novembre 2001
68. M Matucci Cerinic & Generini S: Spondiloartropatie e malattie infiammatorie intestinali. Congresso della Società Italiana di Reumatologia, Padova, 20-24 Novembre 2001
69. M Matucci Cerinic: New insights in the treatment of osteoarthritis-clinical data on the efficacy profile of rofecoxib two years after the launch in Italy. International congress on Successful Aging, Catania 4-6 Dicembre 2001
70. M Matucci Cerinic: Genetica e malattie reumatiche: passato, presente e futuro. Giornate Mediche Toscane, Firenze 1-2 Febbraio 2002
71. M Matucci Cerinic: La visione globale del paziente artrosico: dall’ iter diagnostico alla costruzione di una strategia terapeutica. Osteoartrosi una malattia vera ?, Firenze, 20 Aprile 2002
72. A Pignone, M Matucci Cerinic: Terapia della sclerosi sistemica: stato dell’arte. Le malattie autoimmuni oggi, L’Aquila, 10-11 Maggio 2002
73. M Matucci Cerinic: La patogenesi della sclerosi sistemica. Ten Topics in Rheumatology, Roma, 16-18 Maggio 2002
74. F Braschi, M Matucci Cerinic: A rational approach for the management of ulcers in systemic sclerosis. EULAR congress, Stockholm, 12-16 June 2002
75. M Matucci Cerinic: The heart involvement in systemic sclerosis, Department of Rheumatology, University of Basel, Basel, 29.8.02
76. M Matucci Cerinic: The muscle involvement in systemic sclerosis, Yugoslavian Congress of Rheumatology, Vrdnik, Serbia, 12.9.02
77. M Matucci Cerinic: Overlap Syndromes, Croatian Congress of Rheumatology, Brijuni, Croatia, 18-19.10.02
78. M Matucci Cerinic: From muscle to heart: the silent progression of systemic sclerosis. Grand Round, Harvard School of Medicine, Brigham and Woman Hospital, Bosoton, USA, 22.10.2002
79. A Pignone, G Fiori, M Matucci Cerinic: L’interessamento muscolare nella sclerosi sistemica. Congresso SIR, Bari, 6-8.11.2002
80. M Matucci Cerinic: The peripheral nervous system in systemic sclerosis. Piestany Research Meetings, Piestany, Slovacchia, 21,11,2002
81. M Matucci Cerinic: Approccio terapeutico al paziente sclerodermico. Incontri Catanesi di Medicina Interna, Catania, 29.11.02




