da Leadership Medica n. 7 del 2002
Non è immediato ne’ intuitivo correlare le proprietà macroscopiche di un materiale massivo con le dimensioni infinitesimali delle sue unità costituenti. Eppure, la relazione tra macroscopico e microscopico è tutt’altro che labile. E’ infatti ben noto che le proprietà dei materiali dipendono dalla natura e dalla disposizione reciproca degli atomi o delle unità elementari costituenti. Anche nel più certosino lavoro su un materiale massivo, milioni di atomi vengono manipolati e messi in movimento.
Le analisi teoriche evidenziano inoltre come sia di fatto possibile, senza violare le leggi fondamentali della fisica, riarrangiare le unità fondamentali, una alla volta, con modalità simili a quelle utilizzate con i mattoncini del Lego, per creare nuovi sistemi.
Questo tipo di approccio, meglio noto come nanotecnologia o ingegneria molecolare (molecular manufacturing) consente, opportunamente ottimizzato, di produrre dispositivi più resistenti, più economici, più leggeri, più “intelligenti” (smart).
Nell’ultimo ventennio, l’impulso verso la miniaturizzazione ha permesso di superare le barriere del “micro” e di entrare nel dominio dei “nano”. Una sfida tecnologica stimolata da una crescente domanda per macchine sempre più piccole e supportata in modo massiccio da ingenti investimenti economici da parte di tutti i paese industrializzati
Basti pensare che solo nel V Programma Quadro dell’Unione Europea il finanziamento per attività connesse alla nanotecnologia si assestava a circa 15 miliardi di euro.
Considerate le sue immense e molteplici potenzialità applicative, è ragionevole prevedere che la nanotecnologia sarà, nei prossimi decenni, una delle direttrici strategiche nella ricerca in tutti i paesi industrializzati. Diventa quindi prioritaria l’elaborazione di nuove strategie progettuali e sintetiche che aprano vie di produzione versatili per lo sviluppo di materiali e dispositivi con le proprietà e le funzionalità desiderate.
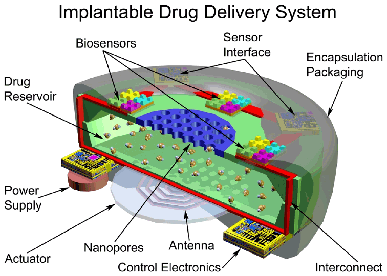 Fig.1 - Un dispositivo submicroscopico per il rilascio controllato di farmaci.
Fig.1 - Un dispositivo submicroscopico per il rilascio controllato di farmaci.Il dispositivo e’ fornito di pori di dimensione inferiore ai 6 nm al fine di proteggere
le sostanze terapeutiche dall’attacco da parte del sistema immunitario.
Tutti i metodi sintetici fino ad ora utilizzati per la realizzazione di nanosistemi possono essere classificati secondo due approcci generali ed antitetici.
Nell’approccio top-down, partendo da oggetti massivi e riducendoli progressivamente attraverso processi quali ad esempio la frantumazione meccanica o la fotolitografia, si raggiungono dimensioni dell’ordine delle decine dei nanometri.
Al contrario, l’approccio bottom up parte dal basso e si fonda sulla manipolazione di atomi o molecole che, opportunamente assemblati, originano quei building blocks molecolari che rappresentano le unità fondamentali della struttura finale.
In una fase scientificamente ancora pioneristica, ma alquanto febbrile per quanto concerne gli sforzi e le risorse messi in campo, la sfida è ora quella di sfruttare gli strumenti messi a disposizione dalla nanotecnologia per manipolare biomolecole che regolano la vita e la morte, la salute e la malattia.
La chiave di volta per concretizzare questi sforzi è acquisire gli strumenti conoscitivi e tecnologici necessari a modulare dispositivi e materiali nella scala dei nanometri e a progettare macchine e strumenti non più grandi di biomolecole quali, ad esempio, il DNA.
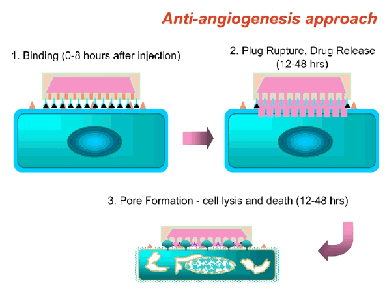 Fig 2 - Con una dimensione laterale di un micron o anche meno, la particella raffigurata nell’illustrazione è più piccola di qualsiasi cellula ematica. Allorché una concentrazione di tali particelle viene iniettata con esito positivo nel flusso sanguigno, queste si muovono liberamente nel sistema circolatorio. Allo scopo di indirizzare tali microparticelle per il rilascio di farmaci nella sede del tumore, la loro superficie esterna viene chimicamente modificata per poter veicolare molecole che abbiano la specificità di legare chimicamente tramite il modello ‘chiave-serratura’ (lock-and-key binding specificity) molecole espresse in particolare dai vasi sanguigni che alimentano masse tumorali. Grazie a ciò, tali microparticelle potrebbero offrire un approccio nuovo e rivoluzionario alla lotta contro i tumori. Non appena le particelle “agganciano” le cellule delimitanti la superficie interna di tali vasi sanguigni, viene rilasciato un composto che produce un foro sulla membrana delle cellule stesse. Questo determina la morte della cellula ed il conseguente collasso dell’intero vaso sanguigno, il che comporta a propria volta la morte della massa tumorale alimentata dal vaso sanguigno stesso. Grazie alla specificità garantita dalla precisione della mira insita nelle molecole poste sulla superficie del microdispositivo, i danni collaterali apportati al tessuto sano sono estremamente limitati sen non assenti, ed il trattamento può essere ripetuto più volte, secondo le necessità.
Fig 2 - Con una dimensione laterale di un micron o anche meno, la particella raffigurata nell’illustrazione è più piccola di qualsiasi cellula ematica. Allorché una concentrazione di tali particelle viene iniettata con esito positivo nel flusso sanguigno, queste si muovono liberamente nel sistema circolatorio. Allo scopo di indirizzare tali microparticelle per il rilascio di farmaci nella sede del tumore, la loro superficie esterna viene chimicamente modificata per poter veicolare molecole che abbiano la specificità di legare chimicamente tramite il modello ‘chiave-serratura’ (lock-and-key binding specificity) molecole espresse in particolare dai vasi sanguigni che alimentano masse tumorali. Grazie a ciò, tali microparticelle potrebbero offrire un approccio nuovo e rivoluzionario alla lotta contro i tumori. Non appena le particelle “agganciano” le cellule delimitanti la superficie interna di tali vasi sanguigni, viene rilasciato un composto che produce un foro sulla membrana delle cellule stesse. Questo determina la morte della cellula ed il conseguente collasso dell’intero vaso sanguigno, il che comporta a propria volta la morte della massa tumorale alimentata dal vaso sanguigno stesso. Grazie alla specificità garantita dalla precisione della mira insita nelle molecole poste sulla superficie del microdispositivo, i danni collaterali apportati al tessuto sano sono estremamente limitati sen non assenti, ed il trattamento può essere ripetuto più volte, secondo le necessità.Prospettive dischiuse anche dai rapidi progressi conseguiti principalmente nella conoscenza dei meccanismi di base: proprio la comprensione dei processi biologici ad un livello molecolare ha reso possibile l’approccio ingegneristico a sistemi naturali complessi in cui convergono, come già evidenziato, discipline molto differenti.
Con qualche ambiguità terminologica, che porta i neofiti a confondere la bioingegneria con l’ingegneria biomedica: mentre quest’ultima si presenta come un campo d’applicazione, seppur marcatamente interdisciplinare, la prima è, di fatto, una disciplina nuova, ma rapidamente in espansione. In questo contesto, la capacità di modulare la struttura dei dispositivi nella scala dei nanometri consentirà di rivoluzionare la medicina e le discipline biomediche ad essa correlate. Il motivo semplice, ma non triviale: l’efficacia terapeutica richiede sempre, ad un certo grado, l’imitazione delle strutture biologiche coinvolte in quel determinato processo, strutture le cui dimensioni approssimano la scala dei nanometri. In questo ambito, un ruolo principe è attualmente giocato dalla fotolitografia. Utilizzando la fotolitografia si è riusciti a collocare singoli filamenti (single strands) di DNA in posizione note e specifiche su un chip. Le sonde reagiscono in modo specifico con elementi singoli di DNA marcati con una sostanza fluorescente, che vengono così rivelati. In questo modo, registrando i punti del chip in cui si osserva la fluorescenza, diventa possibile risalire all’identità biochimica del DNA campione. La fotolitografia, tecnologia di base nella microelettronica e nei MEMS (MicroElectronic Mechanical Systems), si rivela quindi come un approccio estremamente elegante ed innovativo per l’analisi ultrarapida degli acidi nucleici.
E dischiude anche interessanti applicazioni pratiche e praticabili quali la produzione in scala (high-throughput) di nuovi medicinali, la valutazione del rischio genetico, le analisi di medicina legale, l’identificazione di individui, il monitoraggio preventivo della guerra batteriologica (germ warfare). Senza dimenticare che questo tipo di tecnologia ha consentito di concretizzare il concetto di “laboratorio in un chip”, ovvero la miniaturizzazione di strumenti analitici e diagnostici (sensori) al punto tale da poterli includere ed integrare in modo funzionale all’interno di microdispositivi portatili. Tecnologie di questo tipo, basate sulla fotolitografia, vengono chiamate microtecnologie biomediche, bioMEMS.
Il prefisso “micro” non deve tuttavia trarre in inganno: negli ultimi anni, il limite di risoluzione della fotolitografia è stato portato alle centinaia di nanometri, i processi correlati alla microelettronica nel dominio dei “nano”.
E questo nonostante la fotolitografia venga tradizionalmente annoverata tra i processi top-down, dal momento che parte da oggetti macroscopici, come ad esempio strati di materiale depositati su wafer di silicio, e rimuove in modo graduale e controllato sezioni ben definite, creando sul substrato oggetti con dimensioni laterali ridotte fino a 200 nm e qualche angstrom di spessore.
Di fatto, la ricerca biomedica non si è ancora addentrata nel regime dei nanometri. Per farlo, ora, si acquisiscono metodologie e competenze che afferiscono ad altri ambiti, per esempio la tecnologia dei semiconduttori, settore in cui la produzione di chip di qualche centinaio di nanometri è da vari anni consolidata routine. Proprio nei nostri laboratori dell’Ohio State University abbiamo acquisito queste tecniche di fabbricazione per realizzare dispositivi che possano trovare efficace applicazione in patologie quali, ad esempio, il diabete mellito, caratterizzato da un’insufficiente secrezione di insulina da parte del pancreas.
Come verrà più estesamente descritto in seguito, abbiamo di recente realizzato microcapsule di silicio in grado di indurre la sostituzione di cellule non funzionanti con cellule sane. Nel già citato caso del diabete, ad esempio, qualora le cellule non funzionino regolarmente, capsule contenenti cellule sostitutive sane possono essere impiantante sotto la pelle del paziente. Il fornire al corpo nuove cellule rappresenta un metodo molto efficace per trattare alcune malattie, come quelle provocate da deficienza di enzimi o di ormoni.
La ricerca intrapresa in questi anni nei nostri laboratori universitari ed in quelli dell’iMEDD, acronimo per “intelligent MicroEngineered Drug Delivery”, un’impresa spin off nata per rendere commercialmente disponibili i prodotti della tecnologia in questo settore, è stata essenzialmente focalizzata sull’utilizzo della micro- e della nanotecnologia per la realizzazione di dispositivi multifunzionali per scopi terapeutici. Come per esempio dispositivi intelligenti per il rilascio di farmaci che, opportunamente impiantati, siano in grado di localizzarsi nell’area interessata dalla patologia e di rilasciare la sostanza in modo compatibile con gli stimoli esterni ed i segnali biologici.
In questo contesto, il lavoro sperimentale è principalmente rivolto alla micro-manifattura di due classi di dispositivi:
1) membrane con nanopori;
2) organuli (particelle) multifunzionali per il rilascio di agenti terapeutici.
Per quanto riguarda la prima tipologia di sistemi, negli ultimi sette anni, sono stati realizzate nei nostri laboratori numerose varianti di tali membrane in silicio, in cui il comune denominatore è l’utilizzo di uno strato spaziatore, o meglio uno strato sacrificale di silice interposto tra due strati strutturali di silicio. Lo strato sacrificale, una volta assolta la sua funzione di “agente templante”, può essere agevolmente eliminato attraverso un attacco chimico (etching) selettivo, che lascia intatti gli strati in silicio. In questo modo, la geometria dei pori riproduce in modo fedele e preciso quella dello strato sacrificale, la cui microstruttura può essere a sua volta controllata con precisione nanometrica. Questo tipo di tecnologia, basata sul ricorso ad uno strato sacrificale, trae ispirazione dagli “ossidi griglia” largamente utilizzati nella tecnologia dei microprocessori. E, in scale di tempi ben più dilatati, si rifà alle tecniche basate sull’utilizzo della cera come stampo con cui gli artisti dell’antica Grecia forgiavano le loro sculture. Questi nanopori si sono subito rivelati efficaci nella separazione su scala molecolare, come nel caso dell’estrazione di virus da fluidi biologici. La nostra applicazione principale si basa invece sull’utilizzo di bioreattori cellulari che possano essere impiantati per il rilascio fisiologicamente controllato di farmaci. Le nanomebrane possono essere parimenti usate come agenti in grado di regolare il rilascio, su scale di tempi ampi, di biofarmaci dai depositi iniettati. Un’applicazione, quest’ultima, che si realizza grazie ad un trasporto di massa passivo di molecole attraverso canali che hanno un diametro poco più grande di quello delle molecole stesse. Il processo si basa sulla diffusione, ma coinvolge anche tutta una serie di fenomeni molto più complessi ed interdipendenti, come ad esempio l’interazione delle molecole con le pareti dei pori o con altre molecole, fenomeno descritto come “single-file diffusion”.
D’altro canto, un trasporto di massa attivo e di tipo convettivo, come sarebbe richiesto per un dosatore controllato a distanza o auto-regolato, è di fatto reso praticamente impossibile dalle leggi della fisica e dalle caratteristiche dei sistemi coinvolti: la pressione richiesta per spingere un fluido in canali con diametri dell’ordine dei nanometri è di vari ordini di grandezza superiore dell’effettivo carico di rottura dei materiali e delle strutture in gioco. Considerazioni queste che evidenziano come l’ingegneria meccanica possa assumere un ruolo di primo piano nella progettazione e nella realizzazione di nanotecnologie biomediche ad alto contenuto di innovazione. Un approccio, quello mediato dalla nanotecnologia, che promette di rivelarsi assai efficace anche nella terapia genica, in cui vengono richiesti metodi sicuri per fornire geni alla cellula umana. In teoria, molte malattie devastanti ed invasive potrebbero essere curate inserendo frammenti di DNA per “riparare” geni mancanti o difettosi.
Nella pratica, tuttavia, inserire nuovo materiale genetico nella cellula determina marcate e spesso letali reazioni immunitarie. Proprio il responso immunitario rappresenta l’ostacolo maggiore nell’applicazione della terapia genica. Le cellule sostitutive sono estranee al corpo, quindi immediatamente riconosciute ed attaccate dal sistema immunitario dell’organismo ospite, con conseguenze spesso devastanti. Gli strumenti della nanotecnologia consentono anche in questo caso di aggirare l’ostacolo. Poter bloccare gli anticorpi con una barriera artificiale impedirebbe al sistema immunitario di riconoscere le cellule trapiantate. Per questo abbiamo fatto ancora ricorso alle capsule di silicio che inglobano membrane con pori piccoli a sufficienza da non far entrare gli anticorpi, ma grandi abbastanza da consentire il flusso in entrata ed in uscita delle cellule desiderate. L’idea è tanto elegante quanto praticamente ardua: realizzare nanopori piccoli a sufficienza da impedire l’acceso agli anticorpi significa scendere al livello di poche unità di nanometri (pare che la dimensione degli anticorpi sia intorno ai 18 nanometri). L’attuale fotolitografia consente di produrre circuiti dell’ordine di qualche centinaio di nanometri. Adattando questi metodi, siamo tuttavia riusciti a creare pori con un diametro di pochi nanometri.
Ottimizzata la metodologia, come già menzionato, si dischiude la sua applicabilità ad una delle più diffuse patologie, il diabete. In una delle forme della malattia, le cellule pancreatiche che producono l’insulina non funzionano propriamente.
Una delle terapie più efficaci consisterebbe nell’impiantare copie delle “fabbriche” di insulina, le cosiddette “isole di Langerhans”, direttamente nel corpo. Queste potrebbero rimpiazzare le funzionalità pancreatiche difettose e riattivare il normale processo di produzione dell’insulina.
L’impianto di cellule di altri organismi, tipicamente maiali, determina tuttavia l’insorgenza della risposta immunitaria, rendendo necessaria la contemporanea somministrazione di immuno-soppressori che lasciano però il paziente vulnerabile ed esposto ad infezioni. Per evitare ciò, la nostra strategia implica invece il ricorso a dispositivi di rilascio fabbricati con le membrane nanoporose. In questo modo, le piccole molecole di glucosio possono liberamente diffondere attraverso i nanopori nella capsula ed attivare la cellula, ripristinando il controllo sulla produzione di insulina.
L’approccio funziona già in piccoli animali, ma andrà ora ulteriormente ottimizzato e modulato per essere funzionante anche in animali più grandi come ad esempio i cani, prima di essere esteso agli esseri umani. La nanotecnologia offre strumenti versatili ed efficaci anche per la cura dei tumori, per la quale sono richiesti rapidi e significativi progressi. E’ drammaticamente noto quali e quanto devastanti ed invasivi possano essere gli effetti collaterali di una chemioterapia. La principale controindicazione associata all’uso di farmaci chemioterapeutici convenzionali è correlata al fatto che solo una parte relativamente ridotta delle sostanze somministrate raggiunge le cellule tumorali, mentre la gran parte attacca i follicoli dei capelli, il sistema immunitario, i tessuti, inducendo così tutti gli effetti collaterali ben noti: caduta dei capelli, nausea, debolezza. Effetti che hanno reso necessario individuare e sperimentare un approccio più efficace e meno invasivo alla terapia.
Proprio utilizzando la versatilità delle moderne micro- e nanotecnologie, si è giunti alla realizzazione di quelle che, pittoricamente, ma efficacemente, sono state definite “farmacie in un chip”. Pillole che racchiudono funzionalità diverse, ma interconnesse ed interagenti, capaci di liberare in modo controllato la sostanza desiderata nell’organo malato.
Come un piccolo ma scaltro cavallo di Troia, assunta oralmente, la pillola passa indisturbata ed inosservata attraverso il corpo e si insedia nell’organo colpito, ove rilascia poi in modo controllato il farmaco anti-tumorale che distrugge le cellule cancerogene senza determinare ulteriori e indesiderati effetti. La sfida, tanto ardita quanto stimolante, non consiste solo nell’indurre il rilascio del farmaco nel posto giusto, ma anche nel momento giusto.
La ricerca si focalizza quindi sul time controlled delivery, ovvero su un rilascio controllato della sostanza, con cui si possano realizzare schemi di rilascio più complessi determinati non solo dalla variabile “spazio”, ma anche dall’altro fattore terapeuticamente determinante, il “tempo”. Il segreto sta proprio nel dosare il medicinale in modo tale che la quantità rilasciata si collochi esattamente all’interno della cosiddetta “finestra terapeutica” (therapeutic window), al di sotto della quale non si ha alcun sensibile effetto, al di sopra della quale invece si verifica un sovradosaggio che può avere effetti controproducenti, talvolta deleteri. I dispositivi devono poi poter soddisfare alcuni fondamentali requisiti che ne rendano effettivamente praticabile l’utilizzo terapeutico, oltre alle condizioni funzionali già citate (dosaggio del medicinale controllato sia spazialmente sia temporalmente): devono resistere ai drastici cambiamenti di pH che si verificano in alcuni organi (si pensi ad esempio all’ambiente fortemente acido presente nello stomaco); devono poi essere caratterizzati da elevata resistenza meccanica e da biocompatibilità.
Sempre nel campo della lotta ai tumori, un altro progetto intrapreso nei nostri laboratori è invece focalizzato sulla realizzazione di una microparticella intravascolare con una dimensione laterale di meno di un micron. Iniettate in concentrazione adeguata nel flusso sanguineo, queste microcapsule possono muoversi nel sistema circolatorio e raggiungere infine l’obiettivo, ovvero le cellule cancerogene.
Per rendere le microparticelle selettive, la loro superficie viene chimicamente funzionalizzata con molecole che possiedono lock and key binding specificity per molecole espresse dai vasi sanguinei che alimentano la massa tumorale.
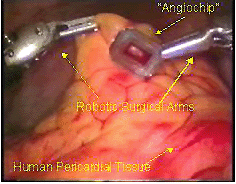
Fig.3 - Biochip che può essere impiantato nel cuore da un robot computerizzato, come dimostrano i professori Michler e Wolf, cardiochirurghi di fama mondiale dell’OSU. Questa poderosa combinazione di chirurgia robotica e di nanotecnologia è indirizzata alla rivascolarizzazione del tessuto cardiaco infartuato – vale a dire alla ripresa della funzione cardiaca susseguente ad un attacco di cuore. Solamente la Ohio State University è attrezzata per espletare questa rivoluzionaria innovazione.
Proprio questa selettività fornisce un rivoluzionario approccio alla terapia dei tumori. Nel momento in cui la particella si aggancia sulle cellule che delimitano la superficie interna di questi vasi, viene rilasciato un composto che produce un foro sulla membrana di queste cellule. Questo determina la morte della cellula ed il conseguente collasso dell’intero vaso sanguigno, che determina a sua volta la morte della massa tumorale alimentata dal vaso sanguineo stesso. Grazie alla specificità delle molecole sulla superficie del microdispositivo, il danno apportato al tessuto sano è estremamente limitato ed il trattamento può essere iterato più volte, se necessario.
Un approccio che, ottimizzato, consentirebbe, tra le altre cose, di alleviare nel paziente le molte sofferenze provocate dai trattamenti tradizionali. Le nanotecnologie servono anche a questo.
Mauro Ferrari Ph.D.
Director of the Biomedical Engineering Center
at The Ohio State University-US
Silvia Gross
Ricercatore at Institute of Molecular Sciences and Technologies (ISTM) of the Italian National Research Council (CNR)
Bibliografia
1. T.A. Desai, W.H. Chu, J.K. Tu, G.M. Beattie, A. Hayek, and M. Ferrari, “Microfabricated Immunoisolating Biocapsules”, Biotechnology and Bioengineering, Vol. 57, No. 1, pp.118-120, 1997.
2. T.A. Desai, W.H. Chu, J. Tu, P. Shrewsbury, and M. Ferrari, “Microfabricated Biocapsules for Cell Xenografts: a Review”, Micro and Nanofabricated Electro-Optical- Mechanical Systems for Biomedical and Environmental Application, Ed. P. Gourley, SPIE Proceeding Series, Vol. 2978, pp. 216-226, 1997.
3.W.H. Chu, T. Huen, J. Tu, and M. Ferrari, “Silicon-micromachined Direct Pore Filters for Ultrafiltration”, Micro and Nanofabricated Electro-Optical- Mechanical Systems for Biomedical and Environmental Application, P. Gourley, Ed. SPIE Proceeding Series, Vol. 2978, pp. 111-122, 1997.
4. T.A. Desai, W.H. Chu, G. Rasi, P. Sinibaldi-Vallebona, P. Borboni, G. Beattie, A. Hayek, and M. Ferrari, “Implantation of Microfabricated Immunoisolating Biocapsules”, Micro and Nanofabricated Electro-Optical- Mechanical Systems for Biomedical and Environmental Application, Ed. P. Gourley, SPIE Proceeding Series, Vol. 3258, pp. 40-47, 1998.
5. D. Hansford, T. Desai, J. Tu, and M. Ferrari, “Biocompatible Silicon Wafer Bonding for Biomedical Microdevices”, Micro and Nanofabricated Electro-Optical- Mech. Systems for Biomedical and Environmental Application, Ed. P. Gourley, SPIE Proceeding Series, Vol. 3258, pp. 164-168, 1998.
6. W.H. Chu, R. Chin, T. Huen and M. Ferrari, “Silicon Membrane Nanofilters from Sacrificial Oxide Removal”, Journal of MicroelectroMechanical Systems, Vol. 8, No. 1, 1999.
7. T.A. Desai, W.H. Chu, G. Rasi, P.S. Vallebona, E. Guarino, and M. Ferrari, “Microfabricated Biocapsules Provide Short-Term Immunoisolation of Insulinoma Xenografts”, Biomedical Microdevices, Vol. 1, No. 2, 131-181, 1999.
8. J.K. Tu, T. Huen, R. Szema, and M. Ferrari, “Filtration of Sub-100nm Particles Using a Bulk-Micromachined, Direct-Bonded Silicon Filter”, Biomedical Microdevices, Vol. 1, No. 2, 113-120, 1999.
9. T.A. Desai, D. Hansford, M. Ferrari, “Characterization of Micromachined Silicon Membranes for Immunoisolation and Bioseparation Applications”, Journal of Membrane Science, Vol. 1, No. 11, 1999.
10. T. A. Desai, D. J. Hansford, L. Kulinsky, A. H. Nashat, G. Rasi, J. Tu, Y. Wang, M. Zhang, and M. Ferrari, “Nanopore Technology for Biomedical Applications”, Biomedical Microdevices 2:1, 11-40, 1999.
11. H-Y. Ying, N. Holman, M. Zhang, M. Ferrari, et al., “Detecting Exposure to Environmental Organic Toxins in Individual Cells: Towards Development of a Micro-fabricated Device,” Micro and Nanofabricated Structures and Devices for Biomedical Environmental Applications II, Ed. M. Ferrari, SPIE Proceeding Series, Vol. 3606, pp. 55-62, 1999.
12. L. Kulinsky, Y. Wang, and M. Ferrari, “Electroviscous Effects in Microchannels,” Micro and Nanofabricated Structures and Devices for Biomedical Environmental Applications II, Ed. M. Ferrari, SPIE Proceedings Series, Vol. 3606, pp. 158-168, 1999.
13. Y. Wang and M. Ferrari, “Surface Modification of Micromachined Silicon Filters” Journal of Materials Science 35:1-8, 2000.
14. M. Ferrari, “Nanomechanics, and Biomedical Nanomechanics: Eshelby’s inclusion and inhomogeneity problems at the discrete/continuum interface”, Biomedical Microdevices, 2:4, 273-281, 2000.
15. P. Goldschmidt-Clermont, D. Kandzari, S. Khouri, M. Ferrari, “Nanotechnology Needs for Cardiovascular Sciences”, Biomedical Microdevices, 3:2, 83-87, 2001.
16. T. A. Desai, D. J. Hansford, L. Leoni, M. Essenpreis, M. Ferrari, “Nanoporous Anti-fouling Silicon Membranes for Implantable Biosensor Applications”, Biosensors and Bioelectronics, Vol. 15 (9-10), pp. 453-462, 2000.
17. N. Moldovan, M. Ferrari, “Prospects for Microtechnology and Nanotechnology in Bioengineering of Replacement Microvessels” , Arch. Pathol. Lab. Med., 126:111-115, 2002.
18. S. Lee, J. Lewis, M. Ferrari, “Biologic Nanotechnology”, Proceedings of the National Academy of Sciences (invited)
19. M. Ferrari, “Drug-Delivery from Micromachined and Nanotechnological Devices,” Pharmaceutical Science and Technology Today, Elsevier, (invited).
20. N. Kyureghyan and M. Ferrari, “Biomechanical Factors That Determine Molecular Therapeutic Uptake in Cancer: A Poroelasticity-Based Model and Parameter Study”, Computer Modeling in Engineering and Sciences, (submitted).




