da Leadership Medica n. 278 del 2009
PRESUPPOSTI TEORICI E CLINICI
Il progressivo instaurarsi di un ridotto apporto di sangue a livello degli arti è dovuto alla presenza di una arteriopatia cronica degli arti inferiori e rappresenta un'espressione di un'aterosclerosi aggressiva con un alto rischio di perdita dell'arto. Infatti l'arteriopatia cronica degli arti inferiori può evolvere in alcuni pazienti in ultima analisi all'amputazione dell'arto inferiore, passando attraverso la comparsa di dolore a riposo, di lesioni cutanee, che non guariscono, ulcerazioni, gangrena e superinfezioni di lesioni ischemiche. La stessa ischemia critica è caratterizzata dalla presenza di dolori a riposo, dall'impossibilità a camminare, e dalla perdita di sostanza a livello degli arti inferiori fino all'amputazione. Il rilievo dei sintomi della claudicatio e la prevenzione di una progressione della malattia aterosclerotica verso stadi più elevati si basa sul miglioramento della circolazione, prima che si instaurino delle lesioni trofiche agli arti inferiori. Per tale motivo occorre in primo luogo modificare gli stili di vita con abolizione del fumo, sviluppo dell'esercizio fisico, e calo ponderale; in secondo luogo occorre correggere con la terapia medica l'ipertensione arteriosa, il colesterolo, il diabete e l'insufficienza renale cronica. Nei casi più severi di arteriopatia occorre procedere al salvataggio d'arto attraverso delle procedure che provvedano direttamente e velocemente a migliorare la vascolarizzazione periferica. Tali metodiche possono essere di natura chirurgica o endovascolare. Le metodiche chirurgiche hanno come finalità quella di rimuovere chirurgicamente l'ostruzione o portare il sangue superando la zona di ostruzione. Le tecniche di rivascolarizzazione endovascolare si sono recentemente sviluppate e consentono attraverso una serie di nuovi cateteri di ri-aprire vasi chiusi, come la crioangioplastica, angioplastica, stenting, aterotomia con rotablator. Questo improvviso aumento dei presidi medici e chirurgici ha portato tra il 1998-2003 ad una riduzione dei tassi di amputazione del 21%.(1)
Lo sviluppo di queste tecniche o di metodiche alternative di rivascolarizzazione sono urgentemente necessarie per ridurre il numero di amputazioni e quindi l’impatto devastante sull’aspettativa e sulla qualità di vita.
FISIOPATOLOGIA DELL'ISCHEMIA CRITICA
I pazienti con ischemia critica presentano una riduzione di flusso a livello degli arti inferiori. Questo può essere quantificato attraverso la misurazione del rapporto tra la pressione arteriosa a livello dell'arto inferiore e quella dell'arto superiore. Solitamente la pressione arteriosa a livello dell'arto inferiore è superiore a 100 mmHg. Quando si riduce la pressione di perfusione a livello degli arti inferiori anche l'apporto di ossigeno ai tessuti si riduce. Pertanto i muscoli e la cute, che ricevono un insufficiente apporto di sangue ed ossigeno, iniziano a presentare i segni clinici di ischemia. Uno dei primi segni di ischemia è la comparsa di claudicatio, che dipende dall'apporto insufficiente di sangue ed ossigeno a livello delle logge muscolari durante il camminare e l'esercizio fisico. Il dolore da claudicatio limita inoltre la capacità di camminare e si risolve dopo pochi minuti di riposo. Se il quadro di ischemia è più severo, il dolore compare non solo sotto sforzo, ma anche a riposo con localizzazione agli arti inferiori. Se la pressione arteriosa agli arti inferiori rimane al di sotto di 60 mmHg per un periodo prolungato di tempo, si instaura un quadro di ipoperfusione che porterà all'insorgenza di un a necrosi ed un’ulcera. L'instaurarsi, quindi, di un quadro clinico di ischemia critica richiede un intervento diagnostico e terapeutico rapido al fine di salvare l'arto in crisi. Solo il 50% di pazienti con ischemia critica avanzata possono essere rivascolarizzati; il 25% sono trattati con terapia medica e medicazioni, mentre il restante 25% sono candidati ad un intervento di amputazione d'amblé. Questi pazienti presentano un'altra serie di comorbidità: cardiopatia ischemica, broncopneumopatia cronica ostruttiva, diabete, insufficienza renale cronica, che determinano un'alta mortalità (20-40%) entro 12 mesi dall’insorgenza dell'episodio acuto a livello dell'arto inferiore (1). Nonostante le attuali diverse opzioni terapeutiche, il 25% dei pazienti muore entro l'anno, il 30 % migliora, il 25% andrà incontro ad amputazione ed il 20 % vedrà un peggioramento dell'ischemia critica. Infatti i pazienti trattati con amputazione maggiore, solo il 32% ad un anno dall'intervento riusciranno ad utilizzare una protesi per camminare (3). Sicuramente pazienti diabetici e fumatori hanno una maggiore probabilità di essere amputati una volta instaurato un quadro di ischemia critica, rispetto a pazienti ipertesi e dislipidemici (4).
ULTIME OPZIONI TERAPEUTICHE NEL TRATTAMENTO DELL'ISCHEMIA CRITICA
L'obiettivo del trattamento dell'ischemia critica degli arti inferiori è quello di migliorare l'apporto di sangue a livello dell'arto interessato. Più del 50% dei pazienti è trattabile con chirurgia standard o con approccio endovascolare (5). Nei pazienti con tale patologia ma non suscettibile di trattamento chirurgico o endovascolare sono stati utilizzati fino ad oggi dei farmaci vasodilatatori, i prostanoidi, che hanno avuto successo limitato in quanto hanno portato ad un miglioramento del quadro clinico solo nel 50% dei casi (6) . Pertanto sono state ricercate nuove opzioni terapeutiche per alleviare il dolore, migliorare l'autonomia di marcia e ridurre il numero di amputazioni nei pazienti con ischemia critica non rivascolarizzabili. Si sono studiati meccanismi genetici e cellulari di stimolazione o soppressione della crescita di nuovi vasi che sembrano poter dare buone prospettive. Per questo si è pensato di tentare con la terapia basata sulle cellule staminali. Ne è un esempio il lavoro di J. Isner et al. che hanno visto che la crescita di nuovi vasi è un fenomeno comune nell'adulto ed è il fattore che maggiormente regola una varietà di eventi quali la crescita di tumori, la guarigione di ferite e la risposta all'ischemia nelle cellule muscolari degli arti inferiori e del cuore (7). Questo lavoro ha correlato il concetto di angiogenesi alla possibilità che cellule emopoietiche possono differenziarsi in cellule vascolari endoteliali nelle zone di rimodellamento vascolare. L'idea di Isner prevede che l’iniezione di cellule endoteliali progenitrici (EPC) prelevate dal midollo rosso e iniettate nei siti di ischemia, guidate da segnali citochinici, si trasformano in cellule vascolari endoteliali (EC) come parte della formazione di nuovi vasi. Questo processo è definito neo–vascolarizzazione (8,9).
Recenti opzioni terapeutiche per il trattamento dell’ischemia critica degli arti inferiori: cell therapy
Sia nel midollo osseo che nel sangue periferico è stata dimostrata la presenza di una popolazione di cellule monomucleate (MNC) tra cui le cellule progenitrici endoteliali (EPCs). Recenti evidenze mostrano che tali cellule possono differenziarsi sia in cellule endoteliali che in cellule muscolari (8,9,10,11). Questa caratteristica, unita alla loro doppia localizzazione (midollare e periferica), ha portato ad un nuovo concetto di formazione di nuovi vasi sanguigni, per cui dal tradizionale concetto di angiogenesi, con cui ci si riferisce alla formazione di nuovi vasi sanguigni a partite da cellule endoteliali pre-esistenti mediante processi di migrazione e differenziazione cellulare (11), si passa al concetto di vasculogenesi, riferendosi in tal senso alla formazione in situ di nuovi vasi sanguigni a partire da progenitori di cellule endoteliali (EPC) che dal midollo osseo migrano nel sito di ischemia e portano alla formazione di cellule mature. Ciò avviene attraverso processi di adesione, proliferazione, differenziazione e rilascio di mediatori (8,12,13).
Le EPC, sia midollari che del sangue periferico, presentano markers di superficie quali CD133 e CD34 (10,12). Esse sono indistinguibili dalle cellule staminali emopoietiche fintanto che non vengono indirizzate da segnali cellulari verso la differenziazione nella linea endoteliale o muscolare. Infatti, le cellule CD34+ sono cellule multi-potenti e possono differenziarsi lungo entrambe le linee maturative (9). Il midollo osseo, inoltre, oltre alle cellule deputate alla rigenerazione cellulare e tissutale, possiede anche cellule accessorie che supportano l'angiogenesi e la vasculogenesi producendo citochine e fattori di crescita. Tali molecole sono essenziali nel processo di differenziazione cellulare delle EPC.
Le EPCs sono presenti nel sangue periferico di pazienti con danno endoteliale, i.e. in pazienti con aterosclerosi, apparentemente con il ruolo di riparare tale danno. È stato però dimostrato che l'azione delle cellule nucleate presenti nel sangue periferico è minore di quella delle stesse cellule prelevate dal midollo osseo (14). Il potenziale effetto terapeutico delle MPC prelevate dal midollo è dovuto non soltanto al loro numero e tipo, ma studi pre-clinici hanno stabilito la loro importanza nel promuovere il rilascio di diverse citochine che inducono lo sviluppo di arterie collaterali in modelli animali di ischemia, sia periferica che miocardica (15). In particolare, è stato visto che il VEGF induce la mobilizzazione dei progenitori endoteliali indotta dall'ischemia o da altri fattori di crescita e citochine e media la loro proliferazione e la differenziazione di queste cellule in cellule endoteliali e muscolari mature (8,13,14).
Quindi, le cellule derivanti dal midollo osseo, tra cui sono comprese le EPCs, contribuiscono al processo di neovascolarizzazione direttamente, attraverso la formazione di cellule muscolari lisce ed endoteliali mature, ed indirettamente tramite il rilascio di molteplici citochine e fattori di crescita che stimolano tale processo (9,10,11,16). Pertanto, la presenza di progenitori cellulari e citochine sembra avere effetti terapeutici ripristinando il flusso sanguigno in tessuti ischemici.
Diversi studi in vivo su modelli animali hanno ben documentato l'effetto positivo delle MPC derivanti dal midollo osseo nel trattamento di tessuti ischemici mediante la formazione di vasi collaterali. (17,18). Sono stati studiati sia modelli di ischemia miocardica sia di ischemia periferica (19,20,21) e tutti hanno mostrato sicurezza ed efficacia di trattamento con tali tecniche. Anche diversi studi su pazienti ed uno studio randomizzato hanno evidenziato le potenzialità terapeutiche e la sicurezza del trapianto di cellule prelevate da midollo osseo autologo in pazienti con ischemia critica degli arti inferiori (22,23,24), uno fra tutti lo studio condotto da Tateishi et al. nel quale sono stati trattati 47 pazienti con ischemia critica di degli arti inferiori non suscettibili di rivascolarizzazione chirurgica, trattati invece con concentrati cellulari estratti da midollo osseo autologo che hanno mostrato, rispetto ai controlli trattati con placebo, un netto miglioramento del flusso sanguigno dimostrato con miglioramento dell'autonomia di marcia, aumentata saturazione tissutale d'ossigeno e significativa riduzione del dolore.
Per quanto riguarda le tecniche di estrazione di tali cellule dal midollo, numerose evidenza dimostrano che il sistema definito “Harvest BMAC system” permette di ottenere migliori risultati se paragonato ai metodi classici (Ficoll e Harvest diluite). Tale tecnica separa e concentra l'intera popolazione di cellule nucleate presenti nell'aspirato midollare. È una tecnica veloce e non operatore dipendente e mantiene nel sedimento cellulare piastrine e granulociti che hanno un effetto positivo soprattutto nella produzione e rilascio di citochine e fattori di crescita pro-angiogenici (soprattutto VEGF che stimola le cellule CD34+ a produrre cellule endoteliali mature da EPCs). Dato che è stato dimostrato da Heeschen et al che la capacità migratoria del BM-MNC's resta l'unico fattore di predizione indipendente per la neoangiogenesi in modelli di ischemia critica animale (24,25), e che tale capacità viene preservata dalla minima manipolazione che le cellule subiscono durante e dopo il prelievo dal midollo, il sistema Harvest garantisce minima manipolazione e minima alterazione funzionale di tale cellule ed è quindi da preferire agli altri metodi.
Per quanto riguarda la concentrazione cellulare ottimale, l'unico studio randomizzato controllato prevede la somministrazione di una quantità compresa tra 0.7 e 2.8x10^7 cellule e 3.4x10^9 CD34+ cellule staminali. Queste cellule vengono preparate a partire da 500 ml di aspirato midollare (26).
Questo studio propone una concentrazione ottimale di 3.56 x 10^9 cellule nucleate con un range compreso tra 2.37 e 4.76 x 10^9. Questo numero è maggiore del limite alto del range utilizzato nello studio di Tateishi-Yuyama e può essere raggiunto prelevando 240 ml di aspirato midollare.
TRATTAMENTO
L'obiettivo di questo trattamento è quello di dimostrare l'efficacia terapeutica del concentrato di cellule nucleate staminali del midollo osseo ottenute utilizzando la tecnologia Harvest nella terapia dell’ischemia critica in pazienti con arteriopatia cronica degli arti inferiori, che è andata progressivamente evolvendo fino a portare alla comparsa di necrosi.
Esistono una serie di vantaggi nell'utilizzo del sistema Harvest:
- il volume dell'aspirato è ridotto a 240 ml;
- l'aspirato è ottenuto in sedazione;
- il processo ha la durata di 15 min e viene compiuto in sala operatoria;
- minor rischio di anemia del paziente;
- minor rischio di contaminazione;
- migliore vitalità cellulare.
 La composizione cellulare ottenuta con il sistema Harvest differisce da quella ottenuta con il metodo Ficoll. La composizione cellulare del sistema Ficoll contiene prevalentemente cellule mononucleate (linfociti, eritroblasti e monociti) e pochi granulociti. È importante notare che non solo con i due sistemi cambia il contenuto di cellule mononucleate ma anche la composizione cellulare. Con il sistema Ficoll, per esempio, sono di norma poco rappresentati i proeritroblasti ed i promieloblasti. Bisogna inoltre ricordare che le cellule staminali mesenchimali possiedono la capacità produrre CFU e di migrare in risposta a SDF-1. Tali specifiche qualità sono maggiormente presenti nelle sospensioni eritrocitarie piuttosto che in una sospensione monocellulare ricavata da aspirato midollare (Fig.1, a fianco: Sistema SmartPReP®2 Bone Marrow Aspirate Concentrate System).
La composizione cellulare ottenuta con il sistema Harvest differisce da quella ottenuta con il metodo Ficoll. La composizione cellulare del sistema Ficoll contiene prevalentemente cellule mononucleate (linfociti, eritroblasti e monociti) e pochi granulociti. È importante notare che non solo con i due sistemi cambia il contenuto di cellule mononucleate ma anche la composizione cellulare. Con il sistema Ficoll, per esempio, sono di norma poco rappresentati i proeritroblasti ed i promieloblasti. Bisogna inoltre ricordare che le cellule staminali mesenchimali possiedono la capacità produrre CFU e di migrare in risposta a SDF-1. Tali specifiche qualità sono maggiormente presenti nelle sospensioni eritrocitarie piuttosto che in una sospensione monocellulare ricavata da aspirato midollare (Fig.1, a fianco: Sistema SmartPReP®2 Bone Marrow Aspirate Concentrate System).
Questo studio valuterà quindi l'ipotesi che il preparato di midollo osseo ottenuto con la tecnologia Harvest, quando iniettato nei muscoli delle logge muscolari, corrispondenti alla zona di ischemia critica, consente lo sviluppo di una circolo collaterale che porta ad una neovascolarizzazione che permette il salvataggio dell'arto, evitando l'amputazione.
Al fine di valutare questa ipotesi verranno arruolati 40 pazienti per uno studio prospettico randomizzato da eseguirsi presso il Dipartimento di Malattie Cardiovascolari del Centro di Ricerca e Formazione ad Alta Tecnologia Nelle Scienze Biomediche "Giovanni Paolo II" dell'Università Cattolica sede di Campobasso.

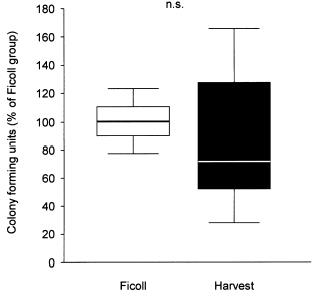
Grafici: Colony-forming activity of isolated BMC using two different protocols (A). Data are presented as percent of colonies observed in the Ficoll group. Transmigratory activity of isolated BMC towards SDF-1 (100 ng/ml) using a modified Boyden chamber assay coated with MatrigelTM (B). Data are presented as percent of cells migrated in the Ficoll group.
Concentration of Bone Marrow Total Nucleated Cells by a Point-of-Care Device Provides a High Yield and Preserves Their Functional Activity Patrick C. Hermann,* et.al Cell Transplantation, Vol. 16, pp. 1059–1069, 2008
Lo strumento tecnico che è utilizzato in questo studio clinico è il sistema SmartPReP®2 Bone Marrow Aspirate Concentrate System, costituito da un microprocessore, da una centrifuga di decantazione, da un kit accessorio, la cui vendita e attualmente autorizzata per la preparazione intraoperatoria di cellule concentrate dal midollo osseo del paziente stesso e per la preparazione di concentrato di piastrine autologhe dal sangue periferico (Fig.1)
OBIETTIVO DELLO STUDIO E SUOI END POINT
Valutare l'efficacia terapeutica delle cellule staminali derivate dal midollo osseo utilizzando la tecnologia Harvest, per la terapia dell'ischemia critica degli arti inferiori in pazienti non suscettibili di rivascolarizzazione chirurgica o endovascolare. L'end point primario è quello di ridurre il numero di amputazioni maggiori, al di sopra del ginocchio, in pazienti affetti da ischemia critica e non più rivascolarizzabili attraverso le tecniche chirurgiche standard o endovascolari. Infatti un amputazione maggiore presenta una più alta mortalità e morbidità, soprattutto cardiologica, rispetto a quelle cosiddette minori. L'amputazione di un arto necessariamente comporta anche delle conseguenze socio-economiche e psicologiche. Infatti la perdita di un arto costruisce per il paziente un grosso trauma psicologico perchè significa spesso perdere volontariamente una parte del proprio corpo, e questo risulta difficilmente accettabile. Inoltre dal punto di vista socio-economico la presenza di un amputazione significa perdere il proprio posto di lavoro e quasi sempre un pensionamento forzato, con riduzione dell'importo del salario mensile. A questo bisogna aggiungere i costi a carico del Sistema Sanitario Nazionale dei sussidi per la mobilizzazione (stampelle, carrozzina) e della protesi, spesso più di una, e i costi relativi al riconoscimento di un invalidità civile per questi pazienti. Di qui la necessità tra gli end point secondari di distalizzare sempre più verso le dita l'eventuale amputazione. Questo consente non solo di ridurre la mortalità e morbilità, ma anche consente una migliore protesizzazione nei casi di amputazione al di sotto del ginocchio, o nell’assenza di protesi nei casi di amputazione transmetatarsale. Inoltre la riduzione del dolore a riposo, la ripresa della deambulazione e mobilizzazione sono end point secondari ma importanti per migliorare la stessa qualità di vita di questi malati. Inoltre il miglioramento dell'ABI, della saturazione dell'ossimetria transcutanea e della circolazione collaterale sono elementi necessari per procrastinare un eventuale intervento di amputazione e aumentare magari in futuro l’autonomia di marcia.
Dopo consenso informato, secondo lo schema ed il modulo proposto dal Comitato Etico dell'Università Cattolica, per il trattamento con le cellule staminali, i pazienti che presentano i criteri di inclusione vengono arruolati in questo studio prospettico osservazionale.
L'efficacia oggettiva della terapia verrà valutata in base ad evidenze clinico strumentali ed alla sopravvivenza senza necessità del paziente di essere sottoposto ad amputazione maggiore dell'arto. In maniera soggettiva si valuterà il dolore riferito dal paziente e la qualità di vita.
MATERIALI E METODI
Abbiamo sottoposto 9 pazienti, 5 donne e 4 maschi, con età media di 66.7 range (54-85 aa), tutti affetti da ischemia critica arti inferiori, già sottoposti a tentativi di rivascolarizzazione chirurgica tramite bypass o angioplastiche periferiche che nel tempo sono falliti e non più suscettibili di alcuna procedura chirurgica o endovascolare di rivascolarizzazione (Fig 2). Questi pazienti sono stati sottoposti ad ecocolordoppler arterioso arti inferiori con determinazione ABI; misurazione della TcPO2 a livello del dorso del piede; Angio-Tac, Angio-RM o Arteriografia degli arti inferiori nei 3 mesi precedenti il trattamento; Determinazione del profilo di rischio cardiovascolare, in base alla presenza di fattori di rischio quali: diabete mellito (glicemia a digiuno e Hb glicata), fumo, ipertensione arteriosa, dislipidemia, PCR (i parametri ematochimici devono essere relativi al massimo alle due settimane che precedono il trattamento). In alcuni casi per valutare meglio la perfusione a livello degli arti inferiori abbiamo eseguito una scintigrafia perfusionale degli arti inferiori con Tetrafosmina sia pre che post impianto per quantificare meglio l'aumento di flusso a livello degli arti inferiori.

Trattamento chirurgico
Eseguita l'anestesia (o in sedazione) vengono prelevati 240 ml. di midollo osseo dalla cresta iliaca e trattati utilizzando la macchina HARVEST (Fig 3). Un campione viene inviato al laboratorio di ematologia per l'analisi del contenuto e della funzionalità cellulare.

Prima di procedere all’iniezione del concentrato di cellule staminali viene determinata l'area ischemica e l'area in cui si vuole determinare la rivascolarizzazione. Vengono segnati sulla gamba del paziente i siti di iniezione (Fig. 4). Le iniezioni devono essere eseguite a distanza di 1-2cm l'una dall’altra, preferibilmente entro 1 cm dal letto vascolare da trattare, per una lunghezza complessiva di 40-80cm e possono essere eseguite sotto guida ecografica. Il volume di ogni iniezione (di concentrato cellulare o di placebo) è di 1 ml (usando un ago 21G delle lunghezza di 2-4 cm, per i piedi 0.5-1 cm). I siti di iniezione vengono in seguito coperti da garze sterili e la gamba avvolta anch'essa da garze sterili.

Nel post-operatorio viene eseguita profilassi antibiotica con Cefazolina 1 g entro un'ora dall'iniezione (in caso di allergie a penicillina, si somministra Vancomicina 1g o Clindamicina 600 mg).
Follow-up:
Tutti i pazienti trattati sono stati e verranno seguiti dopo la somministrazione terapeutica a 1 settimana, 1, 3, 6 e 12 mesi attraverso ecocolordopper arterioso arti inferiori con determinazione ABI, determinazione TcPO2, valutazione soggettiva del dolore e della qualità di vita, Angio-RMN o Angio-TAC aorta + arti inferiori, che verranno eseguiti a 3 e 12 mesi, ed angiografia degli arti inferiori a 6 mesi. I pazienti che hanno eseguito scintigrafia perfusionale degli arti inferiori pre-impianto sono stati sottoposti a controllo scintigrafico a distanza di 3 mesi con determinazione dell’incremento di flusso periferico. L'attuale follow-up risulta essere di breve durata con un follow-up medio di ……giorni (range 7- 180), per cui i risultati risultano essere precoci.
RISULTATI PRECOCI
Non vi è stata a 30 giorni e al follow up a 6 mesi alcun decesso. Solo una paziente ha avuto in V giornata post-operatoria un quadro clinico di edema Polmonare Acuto che ha necessitato di un ricovero in terapia Intensiva per un supporto ventilatorio da cui la paziente è stata progressivamente svezzata.
I pazienti sono stati seguiti con un follow up a 3 mesi attraverso la determinazione dell'ABI, TPO2, Angio RMN aorta +arti inferiori ed in 3 casi con Scintigrafia perfusionale con tetrafosfina ( quelli che avevano un esame nel pre-operatorio). Nell'unico caso con follow-up a 6 mesi è stata eseguita un'angiografia di controllo, come da protocollo, che ha documentato un netto miglioramento della vascolarizzazione periferica.
Tutti questi 9 pazienti erano stati candidati presso Altri Ospedali da diversi Chirurghi Vascolari ad amputazione di coscia. In realtà nessuno di loro ha subito un'amputazione maggiore. I tre pazienti sottoposti avevano già delle lesioni necrotiche quando sono giunti alla Nostra Osservazione; 2 pazienti avevano delle lesioni necrotiche a livello delle dita ed 1 solo a livello del 1/3 medio di gamba.



 Sicuramente tra gli altri parametri analizzati la sintomatologia clinica, ABI e la TpO2 sono le informazioni più significative nel valutare l’efficacia del trattamento (TAB.1,2,3). Apparentemente i risultati ottenuti sembrano essere strettamente correlati con la cellularità dell’espianto. (TAB.4)
Sicuramente tra gli altri parametri analizzati la sintomatologia clinica, ABI e la TpO2 sono le informazioni più significative nel valutare l’efficacia del trattamento (TAB.1,2,3). Apparentemente i risultati ottenuti sembrano essere strettamente correlati con la cellularità dell’espianto. (TAB.4)
Il contenuto cellulare del preparato Harvest è così caratterizzato dall'analisi recettoriale: CD 34+ e CD 34-, CD 133+, CD 133-, CD 133 VEGF, CD 34 VEGF.
DISCUSSIONE
La presenza di un quadro di ischemia critica non rivascolarizzabile sia chirurgicamente che con procedure endovascolari candida in modo inequivocabile il paziente verso l'amputazione. L'utilizzo di cellule staminali autologhe prelevate dal proprio midollo osseo ed iniettate nella stessa seduta operatoria dopo essere state purificate nei muscoli sede di ischemia per occlusione dei vasi arteriosi può costituire una valida opzione da utilizzare. Infatti non vi sono né rischi anestesiologici aggiuntivi, visto che l'intervento viene fatto in anestesia locale associata a blanda sedazione, né rischi infettivi dal momento che si ratta di impiantare nei muscoli tramite delle intramuscolo le proprie cellule staminali prelevate nella stessa seduta operatoria dal midollo osseo attraverso la puntura della cresta iliaca.
Dall'analisi dei risultati precoci della Nostra piccola popolazione è possibile effettuare le seguenti osservazioni. Primo la risposta clinica del paziente è proporzionale alla cellularità del midollo espiantato. Più è alta la cellularità più rapida è la scomparsa della sintomatologia dolorosa a riposo. Secondo in tutti i pazienti si è avuta un incremento dell'ABI e della TpcO2. La presenza di un campione limitato permette di stabilire che questo incremento è statisticamente significativo. In terzo luogo l'amputazione maggiore era prevista nel 100% dei casi, cioè in tutti e 9 pazienti. Solo 3 pazienti, circa il 35 %, sono stati sottoposti ad amputazione ma si tratta di malati che presentavano zone necrotiche già al momento dell’arruolamento. Pertanto si può sostenere che circa il 65% dei pazienti trattati (6 pazienti) hanno salvato la gamba dall'amputazione. Inoltre i tre pazienti sono stati amputati, comunque al di sotto del livello previsto, cioè di coscia, e sono tutti DIABETICI. Infatti la presenza di tale patologia espone ad una maggiore tendenza sia alla superinfezione dei tessuti molli sottostanti alle aree necrotiche sia all'osteomielite. La rapida risposta clinica presente nelle prime 24 ore dall'impianto con scomparsa o importante riduzione del dolore a riposo, dell'ipotermia, sembra essere dovuto a nostro avviso, all'azione delle citochine e di modulatori tissutali rilasciati dalle cellule staminali nelle zone di ischemia periferica.


CONCLUSIONI
Sicuramente sia il numero esiguo della popolazione oggetto dello studio che la durata del follow-up non consentono di fare delle affermazioni definitive, anche se i risultati precoci sono molto confortanti ed importanti. Occorre pertanto continuare a trattare questi malati con ischemia critica non rivascolarizzabile, cercando di essere molto accurati nella selezione dei pazienti in base alla creazione di criteri di inclusione e criteri di esclusione, senza estendere, presi dall'entusiasmo, questa approccio a pazienti con necrosi secca estesa o con ischemia acuta depassè o peggio con quadri di ischemia critica che sta evolvendo verso la gangrena umida, come spesso accade soprattutto nei pazienti diabetici.
Modugno P., De Filippo CM, Caradonna E., Centritto E.M., Amatuzio M., F. Alessandrini.
Bibliografia
1. R. Nowygrod, N. Egorova, G. Greco, P. Anderson, et all.: Trends, complications, and mortality in peripheral vascular Surgery. J Vasc. Surgery 2006; 43: 205-16
2. Clar DG, Dayal R, Faries PL, Bernheim J, Nowygrod R, Lantis JC, Beavers FP, Kent KC. Tibial angioplasty as an alternative strategy in patients with limb threating ischemia. Ann Vasc Surg; 2005 Jan; 1: 63-68
3. M.R. Nehler, Brass E.P., R Anthony; J. Dormandy et all: Adjuntive parenteral therapy with lipo-ecraprost a prostaglandin E1 analog, in patient with critical limb ischemia undergoing distal revascularization does not improve 6-months outcomes
4. Dormandy J, Heeck L, Vig S. The natural history of claudication: risk to life and limb. Semin Vasc Surg. 1999 Jun;12(2):123-37
5. German Diabetes Research Institute. Diabetes mellitus in Germany − Data situation and risk profile, 2003. http://www.diabetes.uniduesseldorf.de/download/Fakten_ zum_Diabetes [facts on diabetes].pdf.
6. Lawall, H. Peripheral arterial occlusive disease: diagnosis and treatment in diabetes mellitus. Cardiovasc. 2;238-43, 2002
7. Isner JM, Asahara T. Angiogenesis and vasculogenesis as therapeutic strategies for postnatal neovascularization. J. Clin Inves 1999; 103: 1231-12365
8. Crosby JR, Kaminski WE, Schatteman G, Martin PJ, Raines EW, Seifert RA, Bowen-Pope DF. Endothelial cells of hematopoietic origin make a significant contribution to adult blood vessel formation; Clin Res. 2000; 87:728-739
9. Hristov M, Erl W, Weber PC. Endothelial Progenitor Cells: Mobilization, Differentiation, and Homing . Arteriosclerosis, Thrombosis, and Vascular Biology. 2003;23:1185-1188
10. Iwasaki H, Kawamoto A, Ishikawa M, Oyamada A, Nakamori S, Nishimura H, Sadamoto K, Horii M, Matsumoto T, Murasawa S, Shibata T, Suehiro S, Asahara Dose-dependent contribution of CD34-positive cell transplantation to concurrent vasculogenesis and cardiomyogenesis for functional regenerative recovery after myocardial infarction. Circulation. 2006; 113: 1311-1325
11. Asahara T, Kalka C, Pastore C, Silver M, Kearne M, Magner M, Isner JM. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization. Circulation Research. 1999; 85: 221-228
12. Caplice NM, Doyle B. Vascular progenitor cells: origin and mechanisms of mobilization, differentiation, integration, and vasculogenesis. Stem Cells Dev. 2005; 14: 122-39
13. Bauer SM, Goldstein LJ, Bauer RJ, Chen HY, Putt M, Velazquez OC. The bone marrow-derived endothelial progenitor cell response is impaired in delayed wound healing from ischemia. J of Vasc Surg. 2006; 43: 134-141
14. Jia L, Takahashi M,Yoshioka T, Morimoto H, Ise H, Uiehi I. Therapeutic potential of endothelial progenitor cells for cardiaovascular diseases. Current Vascular Pharmacology. 2006; 4: 59-65
15. Tareishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, Amano K, Kishimoto Y, Yoshimoto K, Akashi H, Shimada K, Iwasaka T, Imaizumi T, Therapeutic angiogenesis for patients with limb ischemia by autologous transplantation of bone-marrow cells: a pilot study and a randomized controlled trial. The Lancet; 2002; 360: 427-435
16. Seiler C, Pohl T, Wustmann K. Hutter D, Nicolet PA. Promotion of collateral growth by granulocyte-macrophage colony-stimulating factor in patients with coronary artery disease: a randomized, double blind, placebo-controlled study; Circ 2001; 104: 2012-2017
17. Kamihata H, Matsubara H, Nishiue T, Fujiyama S, tsutsumi Y, Ozone R, Masaki H, Mori Y, Iba O, Tateishi E, Kosaki A, Shintani S, Murohara T, Imaizumi T, Iwasaka T. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligans, and cytokines. Circ 2001;104:1046-1052
18. Kamihata H, Matsubara H, Nishiue T, Fujiyama S, tsutsumi Y, Ozone R, Masaki H, Mori Y, Iba O, Tateishi E, Kosaki A, Shintani S, Murohara T, Imaizumi T, Iwasaka T. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligans, and cytokines. Circ 2001;104:1046-1052
19. Shintani S, Murohara T, Ikeda H, Ueno T, Sasaki K, Duan J, Imaizumi T. Augmentation of postnatal neovascularization with autologous bone marrow transplantation, Circ. 2001; 103:897-895
20. Ikenaga S, Hamano K, Nishada M, Kobayashi T, Li T, Kobayashi S, Matsuzaki M, Zempo N, Esato K Autologous bone marrow implantation induced angiogenesis and improved deteriorated exercise capacity in a rat ischemic hind limb model. J Surg Res; 2001; 96: 277-283
21. Yoshida M, Horimoto H, Mieno S, Nomura Y, Okawa H, Nakahara K, Sasaki S. Intra-arterial bone marrow cell transplantation induces angiogenesis in rat hindlimb ischemia. Eur Surg Res 2003; 35: 86-91
22. Iba O, Matsubara H, Nozawa Y, Fujiyama S, Amano K, Mori Y, Kojima H, Iwasaka T. Angiogenesis by implantation of peripheral blood mononuclear cells and platelets into ischemic limbs 2002; 106: 2019-2025
23. Esato K, Hamano K, Li TS, Furutani A, Seyama A, Takenaka H, Zempo N. Neovascularization induced by autologous bone marrow cell implantation in peripheral arterial disease. Cell Transplant 2002;11(8):747-752
24. Saigawa T, Kato K, Ozawa T, Toba K, Makiyama Y, Minagawa S, Hashimoto S, Furukawa T, Nakamura Y, Hanawa H, Kodama M, Yoshimura N, Fujiwara H, Namura O, Sogawa M, Hayashi J, Aizawa Y. Clinical Application of bone marrow implantation in patients with arteriosclerosis obliterans and the association between efficacy and the number of implanted cells. Circ J. 2004; 68: 1189-1193
25. Heeschen C, Hamm CW, Mitrovic V., Lantelme NH, White HD: Platelet Receptor Inhibitionb in Ischemic Syndrome Management ( PRISM ) Investigators. Circulation 2004 Nov 16; 110(20): 3206-12
26. Kawamura A, Horie T, Tsuda I, Ikeda A, Egawa H, Imamura E, Iida J, Sakata H, Tamaki T, Kukita K, Meguro J, Yonekawa M, Kasai M. Prevention of limb amputation in patients with limb ulcers by autologous peripheral blood mononuclear cell implantation Therapeutic Apheresis and Dialysis; 2005; 9:59-63
27. Kisucka J, Butterfield CE, Duda DG, Eichenberger SC, Saffaripour S, Ware J, Ruggeri ZM, Jain RK, Folkman J, Wagner DD. Platelets and platelet adhesion support angiogenesis while preventing excessive hemorrhage. Proceedings of the National Academy of Sciences January 24, 2006; 103:855-860
28. Hill JM, Zalos G, Halcox JP, Schenke WH, Waclawiw MA, Quyyumi AA, Finkel Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 2003 Feb 13;348(7):593-600




