
da Leadership Medica n. 9 del 2003
Dal momento che i sintomi di dell'embolia polmonare (EP) sono alcuni poco specifici, altri poco sensibili, per poter arrivare ad una diagnosi ad alta probabilità di EP vengono utilizzate diverse indagini: Rx torace, ECG, ECO, dosaggi D-Dimero, che ci aiutano più che a fare diagnosi di EP, vista la loro scarsa specificità, ad escludere od a porre diagnosi alternative o più probabili.
La diagnosi di EP è infatti è sia sottostimata che sovrastimata. E' sottostimata perché non sono diagnosticate in vita un terzo delle embolie massive e sub massive specie nei pazienti con malattie avanzate associate (cardiopatici, bronchitici cronici in particolare) o in caso di morte da improvvisa e tumultuosa insufficienza cardio-respiratoria.
E' anche sottostimata per l'imprecisione diagnostica ed il non riconoscimento dei diversi quadri clinici di presentazione, e nel non riconoscimento della loro gravità. L'imprecisione diagnostica (sottostima e sovrastima) dipende anche dalla scintigrafia polmonare perfusionale che è l'indagine più utilizzata per la diagnosi, ma che presenta una sensibilità non molto alta nella maggioranza dei casi (nel 60% circa non risulta diagnostica; in questo gruppo di pazienti solo i1 28% presenta un'EP all'angiografia polmonare.
La scintigrafia polmonare esclude la EP nel 15% dei casi (scan completamente negativo) e lo conferma nel 15% circa dei casi se risulta ad alta probabilità. Per questi motivi si è portati perciò a trattare quando non necessario per evitare eventi fatali. E' fiorita pertanto una grossa mole di lavori a livello internazionale con l'obiettivo di migliorare la strategia investigativa, evitando di sotto/sovrasimare la EP e di utilizzare il meno possibile le indagini radiologiche invasive.
Sono così stati introdotti nella diagnostica l'ecocolorDoppler (ECD) degli arti inferiori, la TC spirale polmonare, l'ecocardiografia, il dosaggio del D-Dimero. Il problema di conciliare le caratteristiche dei vari strumenti diagnostici con le esigenze cliniche è superabile solo con un approccio diagnostico probabilistico (probabilità percentuale di corretta diagnosi con accettazione dei falsi diagnostici) in assenza di strumenti che permettano un approccio deterministico con certezza di diagnosi.
 L'embolia polmonare (EP) è una condizione patologica grave: se non tempestivamente riconosciuta e trattata risulta letale in circa il 10% dei casi.
L'embolia polmonare (EP) è una condizione patologica grave: se non tempestivamente riconosciuta e trattata risulta letale in circa il 10% dei casi.
I maggiori problemi sono quelli di tipo diagnostico poiché non esistono segni o sintomi patognomonici dell'EP e spesso non è agevole identificare, sulla sola scorta dei sintomi, la presenza di trombosi venosa profonda (TVP), che rappresenta la causa prima di EP in oltre l'80% dei casi (1).
L'EP rappresenta la terza causa di morte dopo lo stroke e l'infarto miocardico (6). Rappresenta l'1% delle cause di morte intraospedaliera, con un'incidenza stimata di un caso per mille nella popolazione generale non stratificata per età (2). L 'incidenza raddoppia ogni decade: è rara prima dei 40 anni (3), sicuramente più frequente sopra i 65 anni, interessa più frequentemente il sesso maschile che il femminile, ed è solo lievemente inferiore a quella dello stroke.
Secondo stime anglosassoni (4), confermate da recenti italiane, l' 1% della popolazione ospedaliera presenta una manifestazione di tromboembolismo venoso. L'incidenza della malattia tromboembolica negli Stati Uniti è stata stimata in circa 750.000 casi l'anno con 200.000-300.000 ricoveri ospedalieri (5), mentre in Italia si stima che ogni anno si verifichino 60.000 nuovi casi.
Un terzo degli episodi è fatale e la quasi totalità dei decessi avviene precocemente entro 1 ora dall'esordio dei sintomi. L'aumento dell'età media della popolazione ed il più elevato numero di pazienti che hanno una prolungata sopravvivenza in corso di malattie, neoplastiche, cardiache o polmonare, farà sì che nel futuro il problema possa divenire ancor più rilevante. È pertanto importante conoscere il corteo sintomatologico suggestivo di tale condizione.
L'EP è una condizione clinica potenzialmente fatale, caratterizzata da una presentazione clinica variabile e non vi sono segni o sintomi che possano essere considerati specifici per questa patologia. Ciononostante, la valutazione clinica del paziente con sospetta embolia polmonare, specie quando siano presenti eventuali fattori di rischio, deve essere accurata e critica, perché rimane il principale elemento guida nell'iter diagnostico.
La sintomatologia è estremamente variabile e riflette l'entità dell'impegno vascolare. Nelle forme non massive i sintomi più frequenti sono rappresentati dalla dispnea, dal dolore toracico, mentre la sincope è più frequente nelle forme massive (5).
Talora il paziente può lamentare anche dolore di tipo pleurico, causato da infarto polmonare o da embolia dei rami distali con conseguente irritazione pleurica. Una tachicardia inspiegata, l'improvvisa comparsa di tosse secca, specie notturna, possono essere gli unici elementi clinici che possono far orientare verso una microembolizzazione polmonare.
L'interessamento di vasi di maggior calibro si manifesta invece con la comparsa di dispnea grave ed improvvisa, mentre un dolore toracico similanginoso, da verosimile ischemia del ventricolo destro, è spesso espressione di una maggiore compromissione emodinamica.
Un episodio sincopale o una grave ipotensione fino allo shock sono infine espressione di una embolia polmonare massiva e si associano a segni e sintomi di ipoperfusione quali cianosi periferica e/o oliguria.
L'EP è una sindrome di difficile diagnosi: è importante sospettare la malattia per poterla diagnosticare, ma dal momento che i segni ed i sintomi di EP non sono specifici (7 - 9), sono necessari dei test obbiettivi che ci consentano, in vivo, di confermarla od escluderla.
Elettrocardiogramma
Serve fondamentalmente per escludere altre diagnosi come la pericardite, l'IMA; può evidenziare un sovraccarico dx sistolico e/o diastolico (R alta in V1, BBdx di recente insorgenza) S1-Q3, T negative nelle precordiali (segno di ischemia da compressione delle coronarie con ischernia del ventricolo sx); risulta utile in particolare cioè nelle forme con disfunzione ventricolare dx.
Emogasanalisi
L'ipossiemia è un reperto molto frequente in corso di embolia polmonare, ma circa il 20% dei soggetti con EP (specie quelli giovani) presentano una normale pressione parziale di ossigeno.
Poiché l'ipocapnia è un reperto quasi costante all'emogasanalisi, è stato supposto che il riscontro di un'aumentata differenza alveolo-arteriosa di ossigeno potesse rappresentare un elemento diagnostico più sensibile di EP. I risultati di recenti studi sono stati però deludenti in questo senso, in quanto ben il 15-20% dei soggetti con EP presentano una normale differenza alveolo-arteriosa d'ossigeno (10).
Rx torace
Motivo dell'utilizzo: -esclusione di uno pneumotorace, polmonite, edema polmonare, cancro, altre patologie; -può essere suggestivo di EP quando c'è l'infarto polmonare od emorragia polmonare che può presentarsi come una opacità parenchimale od atelettasica semicircolare con la base che aggetta sulla superficie pleurica (51%) (20).
Nell'emorragia polmonare, l'opacità polmonare scompare entro una settimana, mentre nell'infarto dura anche 8-12 settimane.
Altre caratteristiche compatibili con EP sono il versamento pleurico (38%, con la caratteristica di essere piccolo, spesso interessante solo l'angolo costo-frenico), l'atelettasia subsegmentaria, l'infiltrato polmonare; raramente si osserva la oligoemia ( Westermark's sign. 11 %), l'oligoernia regionale con dallo stesso lato lo slargamento dell'arteria polmonare (Fleischer's sign).
E' pertanto utile nella presentazione clinica di infarto od emorragia polmonare, o in caso di collasso in soggetti con riserva cardio-polmonare ridotta per escludere altre malattie, diverse dall'EP, ma che la simulano (Figura 1).
 Figura 1: oligoemia al campo superiore dx (segno di Westermark)
Figura 1: oligoemia al campo superiore dx (segno di Westermark)
e opacità basale a sx (segno di Hampton)
Permette un'appropriata interpretazione della scintigrafia perfusionale polmonare perché in caso di normalità il difetto perfusorio eventuale allo scan acquista notevole probabilità di essere una EP, e l'interpretazione della scintigrafia è ottimale ed inoltre permette di identificare quelle alterazioni che causano un deficit perfusorio non embolico come; BPCO con grosse bolle di enfisema, bronchiectasie evidenti, fibrosi polmonare, interventi chirurgici, processi infettivi, importante cifoscoliosi, recente radioterapia (11).
Ecocardiogramma
L'ecocardiogramma è un esame non invasivo, disponibile in quasi tutti i centri che può risultare di notevole utilità nella diagnostica dell'embolia polmonare. Una dilatazione ed ipocinesia della parete libera del ventricolo destro, un aumentato rapporto RV/LV (causato dal bulging del setto nella cavità ventricolare sinistra), la dilatazione delle arterie polmonari prossimali, un aumentato rigurgito tricuspidalico (di solito a velocità intorno a 3-3,5 m/sec), ed infine una dilatazione della vena cava inferiore, insensibile alle escursioni respiratorie, sono elementi che orientano verso una diagnosi di embolia polmonare massiva (12). L'entità della compromissione funzionale del ventricolo destro risulta il fattore prognostico dotato di maggior potere predittivo di mortalità a breve termine.
Nessuno dei reperti ecocardiografici appare caratterizzato da elevata sensibilità e solo la diretta visualizzazione dell'embolo livello dell'arteria polmonare, con l'ecocardiografia transesofagea, consente di fare diagnosi di certezza di embolia polmonare.
Un ecocardiogramma normale comune esclude una embolia polmonare di rilevante impegno emodinamico anche se non consente di escludere con certezza condizioni caratterizzate da ripercussioni emodinamiche più limitate.
Per quanto riguarda tutte le situazioni intermedie (che costituiscono in realtà la maggior parte delle forme di embolia polmonare), il ruolo dell'ecocardiografia nella diagnostica dell'embolia polmonare merita di essere pienamente valutato, soprattutto nell'ambito di studi clinici prospettici, in particolare al fine di identificare pazienti con embolia polmonare che possano beneficiare di un trattamento trombolitico piuttosto che della terapia eparinica nonostante l'assenza di ipotensione sistemica o di shock (13).
Dosaggio d-dimero
Il D-Dimero (DD), è un prodotto di degrado della fibrina; esprime la attivazione della trombina e della fibrinolisi. Può essere misurato con metodi quantitativi (ELISA) o serniquantitativi (latex e simili, utilizzando monoclonali).
Mentre i test quantitativi in ELISA hanno bisogno di 5-6 ore per poter arrivare al risultato, i test semiquantitativi richiedono solo 20-30 minuti. Tutti i metodi per testare il DD sono stati validati in numerosi studi pubblicati e la loro accuratezza è stata stabilita. Il DD ha un valore predittivo negativo del 98% contro però una specificità del 35%, legata al fatto che la coagulazione può essere attivata da molte condizioni come il cancro, infezioni, malattie epatiche, scompenso cardiaco, interventi chirurgici, malattie infiammatorie.
Anche variando il cut-off si possono ottenere specificità maggiori ma sempre con una perdita in sensibilità non riuscendo a raggiungere un compromesso accettabile per un rapporto costo- beneficio favorevole.
Una review (14) che valuta l'utilizzo del DD da un punto di vista prettamente clinico per escludere la EP o TVP senza l'utilizzo di altri indagini, conclude che rimane ancora non provata la sua utilità.
Numerosi sono i motivi che rendono problematici il dosaggio del DD e la sua interpretazione clinica probabilistica nei pazienti che si presentano con sintomi (nei pazienti che si presentano asintomatici per TVP non è considerato utile dosare il DD (15) in quanto:
l) la presenza di altre malattie attivanti la coagulazione rendono il DD positivo,
2) dipende dal tempo di comparsa dei sintomi, perché anche se ci troviamo di fronte ad un paziente che non presenta patologia concomitante dopo 10 gg dall'evento trombizzante il DD risulta a1 95% negativo, pur in presenza di malattia,
3) per ultimo ma per questo non meno importante il rapporto costo - efficacia risente molto della prevalenza di malattia (16, 17), per cui sarebbe da utilizzare in caso di prevalenza di malattia bassa (18) da solo od in associazione con il Doppler venoso e con 1 'EGA (19).
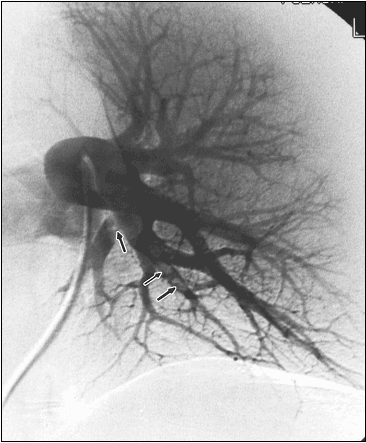 Figura 2: Angiografia polmone sx: Difetti di riempimento
Figura 2: Angiografia polmone sx: Difetti di riempimento
dei rami delle arterie del lobo inferiore sx (freccette)
Doppler venoso degli arti inferiori
EP e TVP degli arti inferiori possono essere considerate come parte di un'unica entità clinica definita “tromboembolismo venoso”.
Studi autoptici hanno infatti documentato che nel 90% dei soggetti con embolia polmonare è presente una trombosi a livello delle vene degli arti inferiori. Il rilievo strumentale di trombosi venosa profonda in pazienti con sospetta embolia polmonare è un elemento che induce a proseguire la terapia anticoagulante e rende sostanzialmente inutile un'ulteriore valutazione invasiva.
L'esame ultrasonografico in B-mode, integrato dalla metodica color Doppler si è dimostrato particolarmente utile specie nelle trombosi venose al di sopra del ginocchio.
La mancata comprimibilità del vaso venoso costituisce il criterio diagnostico dotato di maggior specificità, mentre minore valore diagnostico hanno il rilievo di una iperecogenicità intraluminale o di alterazioni del segnale color Doppler (20).
La diagnosi clinica di TVP, come ormai ampiamente sottolineato da numerosi studi, risulta scarsamente affidabile consentendo di formulare una diagnosi corretta in meno del 50% dei casi.
Anche se la maggior parte dei pazienti con embolia polmonare non ha sintomi o segni di trombosi venosa, la specificità dell'esame Doppler in pazienti con EP rimane alta (circa il 97%). Peraltro lo studio Doppler documenta una trombosi venosa solo nel 30-50% dei pazienti con provata embolia polmonare di modo che l'esame è dotato di elevata specificità ma scarsa sensibilità. Un normale esame Doppler non esclude pertanto la presenza di embolia polmonare.
Alcuni autori suggeriscono di effettuare uno studio Doppler delle vene degli arti inferiori qualora, pur in presenza di un sospetto clinico, l'esame scintigrafico sia risultato normale. Nell'eventualità che anche l'esame Doppler sia negativo, si pensa infatti che il rischio tromboembolico sia così basso da permettere la sospensione del trattamento anticoagulante. Si stanno valutando protocolli diagnostici che prevedano esami Doppler in serie in questi soggetti allo scopo appunto di migliorare la sensibilità del test (21).
La indagini non invasive di primo livello, in conclusione, possono risultare di aiuto nel confermare il sospetto diagnostico di embolia polmonare in attesa di una conferma definitiva della diagnosi.
T C spirale polmonare
La TC spirale è in grado di riconoscere gli emboli a livello dei tronchi polmonari ed a livello delle arterie segmentarie che vengono evidenziati come difetti di riempimento. Recenti affinamenti nella tecnica può portare la risoluzione anche a livello subsegmentario (22).
La percentuale degli emboli subsegmentari è stata stimata sul 6% e risultano pericolosi nei pazienti con riserva cardio-polmonare compromessa. La tecnica TC è sicuramente meno complessa della angiografia polmonare e sicuramente di più rapida esecuzione. La sensibilità e specificità per i trombi segmentali e centrali è alta (92%) (23 - 25), per cui è proponibile l'utilizzo:
1 Per pazienti con sospetto di EP con quadro di presentazione clinica severo (sincope, ipotensione, shock, o dispnea isolata improvvisa)
2 Va anche richiesta in presenza di anomalie all'Rx del torace, scintigrafia non diagnostica (Intermedia e bassa probabilità), ECD negativo in pazienti con riserva cardio- polmonare ridotta.
3 E' infine indicata nei pazienti con discrepanza tra probabilità scintigrafica e clinica, con ECD negativo in pazienti con riserva cardio-polmonare normale. In conclusione rimane difficile con le attuali evidenze considerare come gold standard la T C spirale polmonare; un suo sicuro vantaggio e' la possibilità di diagnosticare una malattia polmonare diversa dall'EP .
Gioca un ruolo diagnostico importante nelle forme a presentazione severa sia per conferma di EP che per diagnosi alternative (25, 26).
Scintigrafia polmonare
La scintigrafia polmonare ha un ruolo chiave nella diagnostica dell'embolia polmonare, essendo un esame non invasivo, ampiamente valutato in grandi trial clinici. Teoricamente la contemporanea acquisizione delle immagini perfusionali e ventilatorie consente di evidenziare eventuali difetti perfusionali in presenza di una normale fase ventilatoria, elementi che consentono una sicura diagnosi differenziale con condizioni nelle quali deficit di perfusione e di ventilazione possono coesistere.
Recenti dati dello studio PISAPED (27) hanno comunque evidenziato un elevato valore predittivo positivo e negativo della sola scintigrafia di perfusione qualora il sospetto clinico sia elevato.
Un importante limite dell'esame scintigrafico è rappresentato dall'ampia variabilità tra due osservatori che può raggiungere anche il 10-20%. Durante l'esame scintigrafico le immagini vengono acquisite almeno in sei proiezioni. Nella fase ventilatoria possono essere utilizzati vari traccianti, quali particelle di carbone marcate con tecnezio 99 oppure xenon 133.
Per la fase perfusionale vengono invece impiegate particelle di albumina marcata con Tecnezio 99, che, in presenza di una normale perfusione, si distribuisco in modo uniforme in tutto l'albero vascolare. In caso di ostruzione di un ramo arterioso, il distretto a valle apparirà “freddo”, privo cioè di marcante. Nello studio PIOPED (23) una scintigrafia considerata “ad elevata probabilità” si associa ad embolia polmonare nel 96% dei casi, tuttavia in pazienti con un esame definito “a bassa probabilità” è stata dimostrata l'esistenza di embolia polmonare anche nel 40% dei pazienti.
Nello studio PISAPED (27) è stata utilizzata esclusivamente la scintigrafia polmonare di perfusione e la diagnosi di embolia polmonare è stata formulata in presenza di difetti perfusionali a carico di uno o più segmenti al fine di cercare di eliminare esami a probabilità intermedia di malattia. Secondo questo schema di classificazione, un esame scintigrafico positivo è risultato avere un potere predittivo positivo del 95%, mentre un esame negativo un potere predittivo negativo del 81%.
Sulla base di questi studi, una scintigrafia polmonare normale esclude con almeno il 95% di probabilità una embolia polmonare così come un esame ad alta probabilità si associa alla presenza di embolia polmonare in quasi il 90% dei pazienti.
Rimane tuttavia un'ampia zona di ombra, costituita dagli esami di media e bassa probabilità, che globalmente costituiscono oltre il 70% dei casi. In questi pazienti la scintigrafia non offre alcun contributo diagnostico definitivo e solo la contemporanea valutazione clinica oltre che la ricerca di una possibile sede di origine dell'embolo possono indirizzare verso la diagnosi.
Se invece il dato scintigrafico è associato ad uno scarso sospetto clinico la probabilità che il paziente abbia una embolia polmonare sono inferiori al 5%. Di per sé invece i rilievi clinici, la radiografia del torace, l'ecocardiografia Doppler e le indagini di laboratorio possono essere di aiuto nel rinforzare il sospetto diagnostico, tuttavia hanno un limitato valore predittivo.
Studi prospettici hanno dimostrato che la presenza di una scintigrafia polmonare negativa identifica comunque una popolazione a basso rischio nella quale la terapia anticoagulante può essere sospesa. Quando la scintigrafia polmonare non sia conclusiva, un'embolia polmonare all'angiografia è stata dimostrata nel 25% dei casi. In questi pazienti quindi è necessario un approfondimento diagnostico prima di qualsiasi opzione terapeutica definitiva.
Angiografia polmonare
E' una tecnica invasiva che viene considerata come gold standard diagnosdco dell'EP (Figura 2). E' una tecnica non priva di rischi (0,5%) di mortalità (28), non è disponibile in tutti gli ospedali, presenta anche ad esperti radiologi difficoltà interpretative ed anche nelle forme subsegmentarie non è cosi precisa come in precedenza si credeva (29, 30).
E' utile nei casi a presentazione severa clinica in cui dopo la TC spirale bisogna con una certa rapidità fare diagnosi per attuare la terapia trombolitica; da evidenziare che le emorragie dopo angiografia sono sicuramente maggiori anche se non importanti quoad vitam. Può trovare un suo ruolo nei pazienti con riserva cardiopolmonare ridotta oltre che quando le indagini precedenti non hanno dato esito positivo.
Si sono costruiti e validati algoritmi diagnostici che tendono ad utilizzarla il meno possibile (31). Venografia arti inferiori Il razionale del suo utilizzo nella diagnostica di EP risiede nel fatto che l'origine dell'embolo ne1 70% dei casi è nelle vene degli arti inferiori.
Da ricordare che ne130% circa dei casi la sede di partenza non è negli arti inferiori. Il riscontro quindi di TVP autorizza quindi ad intraprendere l'anticoagulazione. Sebbene sia considerata il gold standard, la venografia ha un'accuratezza nell'evidenziare una TVP prossimale de160 % (31,32); inoltre non può essere utilizzata in caso di allergia al mezzo di contrasto, e nonostante la protezione del feto e la non estensione allo studio dei vasi pelvici non è da tutti accettata nella gravidanza.
Nella pratica clinica è utile distinguere alcuni sottogruppi confermati da numerosi studi (33 - 36):
1.Frequenza: 4-5% dei casi Collasso circolatorio od ipotensione da sola od associata a perdita di coscienza; può essere presente dolore centrale toracico, o senso d'oppressione, debolezza, ortopnea, giugulari turgide.
L 'ECG spesso evidenzia le alterazioni considerate caratteristiche di EP; la radiografia del torace è spesso normale, i gas nel sangue evidenziano una ipocapnia associata ad importante ipossia che non si corregge con ossigenoterapia al 40%; l'esame fisico permette di evidenziare un soffio sistolico sulla tricuspide che si incrementa con l'inspirazione, un secondo tono rinforzato sulle polmonare con associato soffio sistolico, un battito parasternale.
Poichè molto spesso è presente una occlusione arteriosa polmonare estesa è utile eseguire una ecocardiografia che ci può confermare la diagnosi, evidenziando una disfunzione acuta ventricolare dx , o porre diagnosi alternative. L'ipertrofia del setto depone per disfunzione cronica. Vanno escluse: l'IMA ventricolare sinistro e destro, la polmonite fulminante. lo shock settico, il tamponamento cardiaco, la dissezione aortica, l'emorragia massiva, l'ipokaliemia grave.
2. Frequenza: 60% circa dei casi. Due o più dei seguenti sintomi: dolore toracico pleuritico, dispnea, peggioramento di dispnea, dolore toracico non retrostemale non pleuritico, emottisi, tachipnea, tachicardia. In questi pazienti la radiografia del torace può spesso presentare i segni considerati significativi di infarto ed emorragia polmonare, e localizzati nella sede del dolore pleuritico; l'ECO è il più delle volte normale; lo studio angiografico in questa vasta serie di pazienti evidenzia emboli periferici con occlusione lieve moderata del letto vascolare.
Così nella maggioranza dei casi l'emogasanalisi risulta normale, le alterazioni radiologiche regrediscono rapidamente (1-8 gg), spesso senza arrivare all'infarto polmonare. Le diagnosi alternative sono un folto groppo che va dall'infezione virale o batterica polmonare, alla polmonite, atelettasia postoperatoria, bronchite acuta, dolore muscolo scheletrico, pericardite, pleurite, spasmo esofageo. n dolore dell'EP non cambia mai con gli atti del respiro; molto difficile è la diagnosi differenziale nei soggetti con malattia ostruttiva cronica polmonare. E' sicuramente il groppo di pazienti più cospicuo e con le maggiori difficoltà diagnostiche.
3. Frequenza: 25% circa dei casi Dispnea isolata ad esordio improvviso Il trombo di solito è centrale e questo si riflette sull'emogasanalisi che risulta sempre alterata, la tachipnea molto frequente, possono essere presenti dei segni di ipertensione polmonare acuta, la pressione è sempre normale nei soggetti con riserva cardiorespiratoria normale, non ci sono anomalie all'ECG, l'Rx del torace il più delle volte è negativo è utile eseguire un'ecocardiografia per escludere una disfunzione ventricolare dx che peggiora la prognosi. Quindi, una dispnea acuta in soggetto con fattori di rischio deve far pensare ad un 'EP.
4.Nel rimanente 10% dei casi Vanno considerati quei pazienti, di solito anziani, che presentano un'opacità polmonare alla radiografia, spesso accompagnata da dispnea e/o TVP pregressa. Un piccolissimo gruppo è dato da pazienti con scarsa riserva funzionale: vanno definiti tali i pazienti che presentano una malattia cronica polmonare: o cardiaca sintomatica che vanno incontro a scompenso della patologia preesistente per la comparsa di un'embolia polmonare periferica.
In questi casi l'ECG, l'Rx del torace e l'emogasanalisi non sono utili perché riflettono la sottostante malattia: spesso l'embolia è ricorrente con alta mortalità per non riconoscimento della EP, l'interpretazione della scintigrafia polmonare: è molto difficile.
Sarebbe necessaria l'angiografia polmonare.
La TC polmonare è scarsamente diagnostica. E' un gruppo numericamente esiguo, che pone però seri problemi nella diagnosi.
Dottor Francesco Imperatore
Servizio di Anestesia e Rianimazione, Dipartimento di Emergenza e Accettazione Azienda Ospedaliera
di Rilievo Nazionale “A. Cardarelli”, Napoli
1. Stein PD, Henry JW: Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy. Chest 1995; 1.08:978-81.
2. Anderson Fa Jr, Wheeler HB , Go1dberg RJ, et all. A population based perspective of the hospital incidence of deepvein thrombosis and pulmonary embolism: The Worchester DVT Study. Arch. Intern Med 1991; 151:933- l. 3.Kniffin WD, Baron JA, et all. The epidemiology of diagnosed pulmonary embolism and deep vein thrombosis in the elderly. Arch Intern Med 1994; 154:861-6.
4. Samuel Z, Goldhaber. Pulmonary Embolism. N Eng J Med 1998; 339:93-104
5. ACCP Consensus Committee on Pulmonary Embolism. Opinions regarding the diagnosis and management of venous tbromboembotic disease. Chest 1.996; 1.09:233-7
6. Corris P, Ellis D, Foley N, Miller A. British Thoracic Society, Standards of care Commettee. Suspected acute pulmonary embolism: a practical approach. Thorax 1.997; supplement 4: s8-sl.l
7. Wells P, Jeffrey S, Ginsberg MD, et all. Use of a clinical model for safe management of patient with suspected pulmonary embolism. Ann Inter Med 1998; 129:997-1005
8. Hildner Fj, Ormond RS. Accuracy of the clinical diagnosis of pulmonary embolism. JAMA. 1967; 202:567-70
9. Sasahara AA, Sharma GV, Barsamian EM, et al. Pulmonary Embolism. diagnosis and treatment JAMA. 1983; 249:2945-50
10. Goldhaber SZ, De Rosa M, Visani I. ICOPER. Circulation 1.997; 96: Suppl.
11.Kasper W ,Kostantinides S, Geibel A, et Al. Management strategies and determinants of outcome in acute major pulmonary embolism: result of a multicenter registry. J Am Coll Cardio1997; 30:1165-71.
12. Edwin JR. Monique C, Tiel V B, et all. The value of lang scintigraphy in the diagnosis of pulmonary embolism. NEJM 1993; 20:173-181
13. Goldhaber SZ, Visani L, DeROSA M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry. Lancet 1999; 353:1386-9
14. Becker D, Philbrich J , Bachhuber T, et all. D-dimer testing and acute venous thromboembolism. Arch Intern Med 1997; 156:939-46
15. Crippa L, D' Angelo V.S., Tomassini L, et all. The Utility and cost-effectiveness of D-dimer measurements in the diagnosis of deep vein thrombosis. Haematologica 1997; 446-52
16. Boanemaux H. de Moorleose P, Perrier A, et all Thromb Haemost 1994; 71: 1-6
17. Arnaud Perrier. Non invasive diagnosis of pulmonary embolism. Haematologica; 1997; 82: 328-31
18. Yague S, A normal D-dimer test is useful in excluding pulmonary embolism. JAMA 1993; 270:2819-22
19. Egermayer P, Town GI, Tumer JC, et all. Usefulness of D-dimer, blood gus, respiratory rate measurement for escluding pulmonary embolism. Torax 1998; 53:830-4 53
20. Modan B, Sharon E, Jelin N. Factors contributing to the incorrent diagnosis of pulmonary embolic disease. Chest 1972; 62: 388-93
21. AHA Consultation with the Council on Cardiovascolar Radiology, American Heart Association. Hirsh J, Hoak J. Management of Deep vein thrombosis and pulmonary embolism. 1998. Stein PD, et all. PIOPED J N M, t996; 37:577-81 22.Teigen C L, Maus T P, Sheedy P F, et all. Pulmonary embolism: diagnosis with contrast enhanced electro beam CT and comparison with angiography. Radiology 1995; t94: 3 t3-9
23. Stein PD, et all. PIOPED J N M, t996; 37:577-81
24. Remy G, Remy J, Artaud d, et all. Peripheral pulmonary arteries: optimization of the spiral tc protocol. Radiology 1997; 204:157-63
25. Holbert JM, Costellol P, Federle MP .Role of spiral tc in the diagnosis of pulmonary embolism in the emergency department Ann Emerg Med 1999; 33: 520-8
26. Kim KI, Muller NL, Majo JR Clinically suspected pulmonary embolism : utility of spiral CT .Radiology 199; 210: 693-7
27. Miniati M, Pistolesi M, Marini C. et all. Value of perfusion sacn in the diagnosis of pulmonary embolism: PISA- PED. Am J Respir Crit Care Med.1996; 154: 1387-93
28. Jarden R, Remj J, Wattime L, et all Central pulmonary thromboembolism : diagnosis with the single breath hold comparison with pulmonary angiography. Radiology t 992; 185 :38 t –7
29. Stein PD, Hull RD, Relative risks of anticoagulation treatment of acute pulmonary embolism based on an angiographic diagnosis versus V/Q scan. Chest 1994; 106:727-730
30. Pulmonary Embolism .Williams A. NucMed .1988
31. Stein PD, Athanasoulis C, Alavi A, et al. Complication and validity of pulmonary angiography in acute pulmonary embolism.Circulation. 1992; 85: 462-8
32. Alastair J.J., Wood. Management of Venous Thromboembolism. N Eng J Med 1996; 335:24, 1817-1828
33. Barrit DW, Jordan SC,. Clinical features of pulmonary embolism. Lancet 1961; 729-33
34. Stein PD, Willis PW, Demets. History and physical examination in acute pulmonary embolism in patients without preexisting cardiac or pulmonary disease. Am J CardioI. 1981;47:218-23
35. Stein PD, Terrin ML, Hales CA, et al. Clinical, Laboratory, roengten elettrocardiografic findings. Chest 1991; 100: 598-603
36. Palla A, Petrozzelli S, Donnamaria V, Giuntini. The role of suspicion in the diagnosis of pulmonary embolism. Chest 1995; 107:S 21-4
da Leadership Medica n. 8 del 2003
Ridurre chirurgicamente del 25% - 30% il volume del polmone con resezioni multiple non anatomiche di aree non più funzionanti, mono o bilateralmente, attraverso vie d’accesso tradizionali o per via toracoscopica videoassistita, al fine di consentire una migliore funzione delle regioni residue meno malate, con conseguente miglioramento della morfologia della parete toracica, della conformazione del diaframma e della ridistribuzione della ventilazione, è oggi l’opzione chirurgica più importante e più recente che può essere offerta ai pazienti con enfisema grave. L’intervento era stato già concepito da Brantigan nel 1959, ma è stato modernizzato e riproposto da Cooper a metà degli anni ‘90, grazie alle nuove conoscenze scaturite dal trapianto di polmone. I meccanismi che determinano il miglioramento respiratorio e clinico restano tuttora inidentificati; tuttavia fra quelli proposti vi è il migliorato ritorno elastico che mantiene aperti i bronchioli terminali, il migliorato meccanismo respiratorio della parete toracica e del diaframma, il migliorato rapporto ventilazione/perfusione, la migliorata emodinamica per minore ostacolo al ritorno venoso. Risultati eccellenti, con bassa morbilità, sono stati conseguiti con riduzione volumetrica bilaterale simultanea sia per via sternotomica che toracoscopica videoassistita. Eguali risultati possono essere conseguiti con interventi monolaterali o bilaterali differiti sia per la classica toracotomia con risparmio muscolare sia per via toracoscopica, via che può vantare un minor trauma chirurgico. Tuttavia non è la via d’accesso che determina il risultato dell’intervento ma il tipo stesso dell’intervento che molto spesso è richiesto in pazienti fragili, compromessi nelle condizioni generali e psicologiche. Certamente una valida ed accettata riabilitazione respiratoria pre- e post operatoria può contribuire al conseguimento del successo chirurgico. In ogni caso è sempre bene tener presente che la riduzione di volume polmonare è un procedimento palliativo, ideato per debellare o migliorare la dispnea che affligge i pazienti enfisematosi, spesso ossigeno e farmaco dipendenti, e a consentire una vita quotidiana accettabile, anche se limitata rispetto a quella normale. La selezione dei pazienti è un momento importante e i criteri che la indirizzano sono ancora in evoluzione, includendo un sempre maggior numero di candidati. L’imaging sempre più tecnologicamente idoneo e gli esami funzionali più avanzati per la definizione più precisa possibile del danno parenchimale sono di valido supporto per il chirurgo per identificare e distinguere, all’intervento, le aree bersaglio dalle aree meno danneggiate del polmone e quindi per sottrarre quanto più possibile tessuto polmonare malato e favorire la funzione di quello sano residuo. I benefici che conseguono alla riduzione chirurgica del volume polmonare sia a breve che a lunga durata non sono stati ancora ben determinati per la mancanza di un adeguato follow-up. Tuttavia è certo che l’intervento, sia esso eseguito a cielo aperto che per via toracoscopica, determina miglioramenti soggettivi ed oggettivi significativi che possono essere dimostrati dalla spirometria, dall’ossigenazione, dalla ridotta dispnea ed infine dal cambiamento della vita dei pazienti. Un follow-up più prolungato potrà consentire valutazioni più precise e più convincenti. Esso, inoltre, potrà far scaturire nuove idee. I tempi, all’epoca di Brantingan, non erano maturi per una giusta valutazione della sua idea; ma il passare degli anni, con il progresso della tecnologia e la conquista di nuove conoscenze, ha dimostrato che si trattava di un’eccellente idea.
L’enfisema polmonare, per la sua incidenza e per l’elevata morbilità e mortalità, si colloca, fra i problemi di maggiore impegno delle istituzioni sanitarie mondiale. Il fumo di sigaretta è la causa principale di questa grave malattia che occasionalmente può insorgere anche in soggetti non fumatori ma con deficienza di alfa 1 antitripsina. L’enfisema è una malattia cronica progressiva che evolve verso una crescente invalidità e che comporta una mortalità di 47 uomini e 20 donne per 100.000 soggetti. Il trattamento medico convenzionale dell’enfisema, per diversi decenni, si è imperniato sull’impiego dei broncodilatatori, dei teofillinici e dei cortisonici, con risultati globalmente poco soddisfacenti e miglioramenti limitati specie se riferiti alla funzione polmonare, alla qualità della vita ed alla sopravvivenza. L’ossigenoterapia aggiuntiva impiegata al fine di mantenere al di sopra del 90% la saturazione di O2 si è dimostrata utile per la sopravvivenza, mentre la riabilitazione polmonare, il regime nutrizionale e il supporto psicosociale migliorano la capacità funzionale. In ogni caso, tutte queste modalità non migliorano significativamente la funzione polmonare né sono in grado di incidere sul progressivo deterioramento del parenchima. Il trapianto del polmone e la pneumoplastica riduttiva, nel panorama delle molte soluzioni proposte per trattare chirurgicamente l’enfisema, sono le sole che si sono evolute ed affermate. Realizzato da Hardy nel 1963 il trapianto di polmone si è affermato clinicamente nei primi anni ’80, grazie a progressi pneumologici e chirurgici. La pneumoplastica riduttiva, ideata da Brantigan, sul finire degli anni ’50, dopo un periodo di accantonamento, è stata rilanciata da Cooper nel 1995 grazie alle nuove conoscenze acquisite dal diffondersi del trapianto polmonare. Anche noi abbiamo ritenuto vantaggioso avvalerci di questa metodica con la quale abbiamo conseguito soddisfacenti risultati.

Tommaso Claudio Mineo
Docente al Dipartmento di Chirurgia
Univesità di Tor Vergata Roma
1. Brantigan OC, Mueller E, Kress MB. A surgical approach to pulmonary emphysema. Am Rev Respir Dis 1959; 80: 194-202.
2. Cooper JD, Trulock EP, Triantafillou AN, et al. Bilateral pneumectomy (volume reduction) for chronic obstructive pulmonary disease. J Thorac Cardiovasc Surg 1995; 109: 106-19.
3. Mineo TC, Pompeo E, Simonetti G, et al. Unilateral reduction pneumoplasty for asymmetric emphysema. Eur J Cardiothorac Surg 1998; 14:33-39.
4. Pompeo E, Marino M, Nofroni I, Matteucci G, Mineo TC and the Pulmonary Emphysema Research Group. Reduction pneumoplasty surgery versus respiratory rehabilitation: a randomised trial. Ann Thorac Surg 2000;70:948-954.
5. Pompeo E, Sergiacomi GL, Nofroni I, Roscetti W, Simonetti G, Mineo TC. Morphologic grading of emphy-sema is useful in the selection of candidates for unilateral or bilateral reduction pneumoplasty. Eur J Cardiothorac Surg: 2000;17:680-86.
6. Mineo TC, Pompeo E, Rogliani P, Villaschi S, Pistolese C, Simonetti G. Thoracoscopic reduction pneumoplasty for severe emphysema. Do pleural adhesions affect outcome? Thorac Cardiovasc Surg 1999;47:288-92.
7. Geddes D, Davies M, Koyama H, et al. Effect of lung volume reduction surgery in patients with severe emphysema. N Engl J Med 20-00;343:239-245.
da Leadership Medica n. 4 del 2007
Il Polonio 210 (Po-210), con emivita di circa 138,38 giorni, è uno dei più potenti cancerogeni fra quelli presenti nel fumo di tabacco. Vari studi indicano, come fonte principale di Po-210, il fertilizzante utilizzato in tabacchicoltura, rappresentato dai polifosfati ricchi di radio (Ra-226) da cui emana il radon (Rn-222) che in aria decade a piombo-210 (Pb-210) e in parte a Po-210. Tramite i tricomi il Pb-210 viene concentrato nella foglia di tabacco dove si trasforma in Po-210 che, alla temperatura di combustione della sigaretta (800°-900°C), passa allo stato gassoso, principalmente adsorbito sulle micro-particelle liberate dalla combustione. Il fumo, così diventato radioattivo, nella sua componente gassosa e corpuscolata, arriva a livello dell'apparato broncopolmonare, in particolare sugli speroni. In questa sede in maniera sia singola che sinergica con gli altri cancerogeni, esplicherà, col tempo e specie in pazienti con clearance muco-ciliare molto compromessa, il suo potere cancerogeno. Vari studi confermano che il rischio biologico del Po-210 in un fumatore di 20 sigarette/die per un anno è pari a quello di 300 radiografie del torace, con una capacità oncogenica autonoma di 4 tumori polmonari su 10.000 fumatori. Durante la combustione parte del Po-210 si disperde nell'ambiente circostante e così lo si ritrova anche nel fumo passivo.

Ciononostante 1,200 miliardi persone nel mondo, 47 milioni di statunitensi (25%)6, e 12,2 milioni di italiani (24,3%) continuano a fumare.7,8
Se è vero che i meccanismi carcinogenetici del fumo di tabacco non sono ancora totalmente ben conosciuti9 è altrettanto vero che pochi fumatori e non fumatori sanno cosa, rispettivamente, aspirano e respirano. Il fumo di tabacco è una miscela composta da una fase corpuscolata (5%) e una fase gassosa (95%). Il catrame costituisce la fase corpuscolata totale senza acqua o nicotina. Vi sono 0,3-3,3 miliardi di particelle per ml di fumo di sigaretta e oltre 4.000 costituenti,10 compresi 55 cancerogeni noti, con "sufficient evidence for carcinogenicity" secondo l'International Agency for Research on Cancer (IARC).11
Forse non tutti sanno che fra i cancerogeni organo specifici presenti nel fumo di tabacco, oltre ai già noti Idrocarburi Aromatici Policiclici, al 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK), 2-naftilammina, 4-amminobifenile, arsenico e cromo, ce n'è uno che pochi conoscono e che suo malgrado ha avuto recentemente l'onore delle cronache con la spy story Litvinenko: il Polonio 210 (Po-210). In effetti fino a pochi mesi fa, il Polonio era un elemento sconosciuto ai più. Probabilmente qualcuno lo pensava solo un personaggio dell'Amleto di Shakespeare. E quell'elemento sconosciuto ai più, scoperto nel 1898 da Marie e Pierre Curie e battezzato Polonio in omaggio alla terra natale della signora Curie-Sklodowska, è divenuto oggetto di curiosità massmediatica e medico-scientifica. Per la scoperta di radio e polonio Madame Curie vinse il Nobel per la Chimica nel 1911.

Il Polonio 210, chiamato anche "radio F", fu scoperto dai coniugi Curie mentre questi cercavano la fonte della radioattività della pechblenda detta, in senso lato, anche uraninite, i cui campioni continuavano a manifestare radioattività anche dopo essere stati depurati dal radio e dall'uranio che essi contenevano.12 Per avere un'idea delle dimensioni del lavoro che essi compirono alla fine del 1800 per estrarre e caratterizzare questo nuovo elemento, basti pensare che per ottenere circa 0,1 mg di Polonio occorre una tonnellata di uraninite o pechblenda. Lo si ritrova in natura nelle rocce contenenti pechblenda. Il Polonio, in condizioni standard, è un metallo radioattivo di colore argento. Esso è presente in natura nella pechblenda, ma in maniera così diluita che non è conveniente tentarne l'estrazione per cui l'isotopo più stabile, il Po-210, che ha una emivita di 138,38 giorni, viene prodotto in laboratorio per bombardamento neutronico di Bi-209. Importanti giacimenti di pechblenda si trovano in Canada, USA, Rep. Dem. del Congo (ex Zaire), Rep. Sudafricana. Il Polonio è presente nella tavola periodica di Mendeleev con numero atomico 84 e peso molecolare 210. Di Polonio - esistono 25 isotopi: sono tutti radioattivi e molto pericolosi, ma il Po-210 è il più pericoloso tra i vari tipi esistenti.
Il polonio è un elemento tossico, altamente radioattivo e pericoloso da manipolare, persino in quantitativi dell'ordine del milligrammo o meno. Le radiazioni alfa, costituite da nuclei di elio-4 (He-4), hanno un elevato potere ionizzante e, di conseguenza, sono particolarmente dannose quando entrano in contatto con i tessuti viventi. Il limite massimo tollerabile di radioattività da polonio è 1100 Bq (0,03 µCi), una quantità corrispondente a quella prodotta da 6,8 miliardesimi di milligrammo di Polonio.13
0,1 mg di questo metalloide emette lo stesso numero di particelle alfa di 5 grammi di radio. Un killer potentissimo. L'effetto sull'uomo è dunque devastante: si muore, ovviamente, per conseguenza della radioattività, in quanto si innesca un meccanismo per cui le cellule vanno in necrosi, "come bruciate". Si ha, cioè, un effetto massivo che l'organismo non è in grado di fronteggiare, perché non è capace di "rimpiazzare" in tempi brevi la grande quantità di cellule "bruciate" andate in necrosi.13
Gli usi del Po-210 sono estremamente limitati sia per la sua elevata emissione di radioattività alfa sia per le difficoltà estrattive in natura e in laboratorio. Impieghi principali:
a) Come sorgente di neutroni quando è mescolato in lega con berillio.
b) Come sorgente di energia per satelliti e in altri dispositivi spaziali.
c) Nei dispositivi antistatici di alcuni strumenti di precisione e in speciali spazzole che eliminano la polvere accumulata sui negativi fotografici. Il polonio in queste spazzole è sigillato e schermato in modo da minimizzare i rischi da radiazioni.
d) In dispositivi per eliminare la carica elettrostatica nelle manifattura di stoffe, ma è stato rimpiazzato da sorgenti di raggi beta, più facilmente disponibili e meno pericolose.13

Il Po-210 è un radionuclide alfa-emittente presente in tracce anche in molte piante ed alimenti - che poi ritroviamo nei tessuti umani.14 La maggiore sorgente di apporto di Po-210 naturale è rappresentata dal cibo. Dati di Spencer et al. indicano che il 77,3% dell'apporto giornaliero di Po-210 di un maschio adulto proviene dagli alimenti, il 4,7% dall'acqua e lo 0,6% dall'aria. L'inalazione di fumo di sigaretta apporta molto più Po-210 (17,1%) di quello presente nell'acqua che si beve e nell'aria che si respira messe assieme.15
La scoperta della presenza del Po-210 nel fumo di tabacco risale ai primi anni '60 grazie a Turner e Radley nel 1960, Marsden e Collins nel 1963 e Radford ed Hunt nel 196416, quando gli scienziati individuarono la presenza di radioattività alfa nel tabacco. Il Polonio (Po-210) ed il suo precursore, il Piombo (Pb-210), presenti nelle piante di tabacco possono avere origini diverse.17 Si ritiene che il Po-210 possa essere assorbito dalla pianta del tabacco, attraverso vie variamente combinate fra di loro:
1) Direttamente da terreni contenenti Uranio attraverso le radici.18,19,20
2) Per deposizione sulle foglie, attraverso eventi meteorologici, di pioggia, neve e pulviscolo atmosferico. Infatti il Radon-222, derivato dalla catena di decadimento dell'U-238, essendo un gas nobile, è volatile per cui sfugge, in parte, dal terreno e passa nell'atmosfera, dove decade a sua volta con formazione di Piombo-210 e, in parte, di Polonio-210. Questi assorbiti dal pulviscolo atmosferico formano le particelle di Aitken che si depositano poi sulle foglie delle piante accumulandosi nei tricomi tramite una deposizione diffusiva browniana, con la conseguente crescita nel tempo del Polonio-210 derivante dal decadimento del Piombo-210.21,22 Skwarzec et al. indicano questa via come la principale sorgente di Po-210 nelle piante di tabacco19 in contrasto con gran parte degli autori, e in particolare Singh e Nilekani, che hanno evidenziato l'importanza dei fertilizzanti utilizzati.24
3) Da fertilizzanti costituiti da polifosfati di calcio provenienti da terreni con presenza di Pechblenda e Apatite, che contenendo Uranio e suoi prodotti di decadimento,18,23 sono di conseguenza arricchiti in radio, chimicamente simile al calcio. Non a caso vari studi hanno dimostrato che le sigarette indiane, fatte con tabacco scarsamente concimato, come da agricoltura povera, sono all'incirca da 6 a 15 volte meno radioattive di quelle statunitensi24, fabbricate con tabacchi coltivati in regime di agricoltura intensiva e iperfertilizzata.
La pianta di tabacco ha la caratteristica di essere dotata di numerosissimi tricomi, una specie di pori filamentosi, che sono dei gran concentratori di Pb-210 e Po-210. Fleisher e Parungo hanno confermato sperimentalmente che i prodotti di decadimento del radon ed il Pb210 sono fortemente concentrati nei tricomi delle foglie.22 I meccanismi di accumulo del Pb-210 nei tricomi del tabacco sono stati discussi e studiati da Martell e Poet.25, 2
Il viaggio verso l'apparato broncopolmonare del Po-210 e del Pb-210 inizia con l'accensione della sigaretta, nel fornello di combustione dove, il tabacco, in fase aspirativa brucia a circa 800-900° C. Si forma così il fumo di tabacco che è un melange composto da una fase corpuscolata (5%) e una fase gassosa (95%).10 Considerando le differenti temperature di ebollizione per Po-210 (962° C) e Pb210 (1740° C), nella fase gassosa è presente, fra le altre sostanze, anche il Po-210 che in parte viene eliminato nell'ambiente esterno e in parte viene "a far corpo" con la fase corpuscolata, che conterrà, oltre al Po-210, anche una elevata presenza di particelle insolubili di Pb-210, debole alfa emittente (<1/100.000) gamma, beta e X emittente, e precursore del Po-210. Tutte queste particelle inalate si depositano nell'apparato broncopolmonare ed in particolare, per effetto dell'azione ciliare, a livello delle biforcazioni dei bronchi segmentari. Misurazioni eseguite da Cohen et al. sul condensato di sigaretta hanno mostrato la presenza anche di Radium e Torio, fermo restando che il 99% della radioattività proviene dal Po-21023 che, una volta inalato viene ritenuto nell'apparato broncopolmonare.27
Tutte queste particelle avranno un diverso destino a seconda dell'efficienza della Clearance Muco-Ciliare. Questa depurazione meccanica viene progressivamente a mancare nei fumatori con BPCO. Ciò comporta una stasi della carica radioattiva28 che in parte, attraverso il circolo polmonare e sistemico, raggiunge vari organi e tessuti causando nel tempo mutazioni della struttura cellulare genetica, deviazione delle caratteristiche cellulari dallo standard ottimale, invecchiamento accelerato e morte più rapida ad opera di un largo spettro di patologie.29,30 I livelli di Po-210 sono infatti significativamente superiori, del 30% nel sangue e di 6 volte nelle urine, nei fumatori rispetto ai non fumatori.16,31 Le elevate concentrazioni di Polonio nel polmone dei forti fumatori si possono spiegare soprattutto attraverso l'accumulo di particelle insolubili di Piombo-210 che poi nel tempo decade a Polonio-21021, a causa di un sempre più progressivo rallentamento della Clearance Muco-Ciliare. Più aumenta il grado di BPCO, più aumenta il rischio di accumulo di carica radioattiva.28
La dose-radiazioni apportata dalle concentrazioni locali di Polonio sulla parete dell'epitelio bronchiale, dipende dalla frazione di particelle accumulate in queste aree e dal loro tempo di permanenza. Holzman17 nelle sue ricerche ha dimostrato che le concentrazioni di Pb-210 sono maggiori nello scheletro e nei polmoni dei fumatori rispetto a quello dei non fumatori. Pertanto visto che il Polonio ha un T ½ di 138,38 giorni ed il Piombo, che poi decade in Polonio, di 22 anni, ne deriva che un significativo rischio di cancro49,50 può essere attribuito ad una cronica esposizione a bassi livelli di particelle insolubili alfa emittenti che sono responsabili di dosi locali molto elevate in piccole aree tissutali, soprattutto delle biforcazioni (hot spots).21 Tutto ciò viene facilitato in presenza di un'alterazione della Clearance Muco-Ciliare spesso presente nei fumatori a causa della bronchite cronica, nella quale, come peraltro ha dimostrato Auerbach, sono presenti lesioni metaplasiche dell'epitelio ciliato nel 100% dei forti fumatori.32 Il Po-210, presente nelle particelle insolubili, diventa così più penetrante attraverso le zone disepitelizzate o scarsamente ciliate ove ristagna maggiormente il muco.16,33 Non è un caso la recente osservazione che i pazienti con severa BPCO, fumatori ed ex fumatori, abbiano una maggior incidenza di neoplasia polmonare.28

Il grado di radioattività alfa da Po-210 nel fumo di tabacco dipendente da numerose variabili: la regione geografica dove il tabacco cresce, tempi e modi di stoccaggio del tabacco, presenza o assenza del un filtro, grandezza e composizione del filtro e modo di fumare.50 Il rischio associato al fumo di sigarette è dovuto non solo alla quantità e qualità dei carcinogeni, ma anche alla scarsa efficienza dei filtri usati che non riduce adeguatamente la quantità dei carcinogeni presenti nel fumo di tabacco. L'efficienza media dei comuni filtri di sigaretta utilizzati in commercio riduce l'attività del Po-210 di circa 4,6% del Po-210 contenuto nel tabacco di sigaretta.52 L'utilizzo di filtri di resina minimizza ancora di più l'esposizione dei polmoni dei fumatori alle alfa radiazioni.53 Radford and Hunt16 nel 1964, Mussealo-Rauhammaa e Jaakkola54 nel 1985 hanno riscontrato il 6.5-22% di Po-210 nella corrente primaria del fumo di sigaretta. Altri Autori hanno riportato differenti percentuali valutate in un range di 3.7-58%.55 In media, secondo Parfenov, approssimativamente il 50% del Po-210 presente nel tabacco di sigaretta è trasferito nel fumo, il 35% rimane nel mozzicone e circa il 15% lo si ritrova nella cenere.58 Da alcuni anni, assieme al professor Enrico Gattavecchia dell'Unità Complessa di Scienze Chimiche, Radiochimiche e Metallurgiche dell'Università di Bologna, in collaborazione con l'ENEA e con la Società Italiana di Tabaccologia-SITAB, stiamo effettuando alcuni studi sulla radioattività alfa da Polonio 210 nel fumo di tabacco. Dalle nostre ricerche abbiamo riscontrato che il fumo di una sigaretta manufatta con tabacco occidentale contiene una radioattività alfa da Po-210 di circa 75 mBq, variamente distribuito fra fumo attivo, fumo passivo e cenere: fumo attivo (mainstream) 5 mBq (6,7%), fumo passivo (sidestream) 1,2 mBq (1,6%), (cenere 68,8 mBq (91,7%).43,56,57
Martell stima che la dose cumulativa di radiazioni alfa a livello delle biforcazioni bronchiali del fumatore che muore di cancro polmonare è di circa 80 rad (1.600 rem), che è la dose sufficiente ad indurre trasformazione maligna da interazioni alfa con le cellule basali.34,35 Vari studi sperimentali hanno dimostrato l'induzione di tumori in animali da esperimento dopo inalazioni di Po-210.36 Secondo osservazioni cliniche e sperimentali di Marmorstein,37 il viraggio di istotipo di tumore polmonare che si è osservato negli ultimi 40 anni è dovuto alla radioattività alfa da fumo di tabacco sostenuta dall'uso e abuso di fertilizzanti polifosfatici. L'inutile quanto dannosa componente radioattiva veicolata dai fertilizzanti potrebbe essere ridotta attraverso un uso alternativo delle sorgenti di polifosfati, come i fertilizzanti fosfatici animali38 o con un trattamento degli stessi polifosfati minerali (ammonio fosfato al posto di calciofosfato)38 e/o con tecniche diverse di stoccaggio e/o passando a modificazioni genetiche delle piante di tabacco con riduzione significativa della concentrazione di tricomi sulle foglie di tabacco. Uno studio ha dimostrato che la concentrazione di radioattività da Po-210 nel tabacco aumenta col tempo in fase di stoccaggio, dopo essere stato raccolto39 . Una utile e opportuna raccomandazione dei ricercatori è quella di raccogliere il tabacco ancora verde ed evitare stoccaggi prolungati nei silos per evitare l'aumento delle concentrazioni di Po-210 che avviene per lento decadimento del Pb-210.
Applicando ai valori da noi riscontrati i dati ENEA del 199040 circa il tempo medio effettivo di permanenza nei polmoni per il Po-210, che è di 53 giorni, i dati del Comitato BEIR IV del 198841 sul rischio cancro al polmone in seguito ad esposizione a radom e suoi prodotti di decadimento (Pb-210 e Po-210), i dati corretti e stimati dalla ICRP42 in base ai sopravvissuti alla bomba A, risulta un rischio "puro" di tumore al polmone pari a 4 x 10-4 anno-1 (4 casi su 10.000 fumatori all'anno pari a 4.480 su una popolazione italiana di 12.200.000 fumatori), senza contare il ruolo di promotore (co-carcinogeno) nel tumore broncopolmonare per un'azione complessiva sinergica con le altre sostanze cancerogene, circa 55 note, presenti nel fumo di tabacco. Per capire il danno biologico che può essere causato dal Po-210 presente nel fumo di tabacco, è stato paragonato a quello da Raggi X utilizzati nelle comuni radiografie del torace. Per avere un rapporto con questa comune sorgente di radiazioni, si consideri che una moderna radiografia al torace comporta una dose equivalente pari 0,034 mSv/radiografia,48 per cui, in pratica, un fumatore di 20 sigg./die, in 1 anno riceve una dose di radiazioni equivalenti a circa 300 radiografie al torace.43,44
Ciò che comunque determina l'impennata del rischio cancerogenesi, non è tanto l'azione singola e neanche la sommatoria della radioattività alfa agli idrocarburi policiclici, agli altri cancerogeni ed ai radicali liberi (prodotti per pirolisi e per danno da radiazioni alfa), quanto l'azione sinergica e moltiplicativa dei singoli componenti carcinogeni e co-carcinogeni.44,45,46,47
La presenza di Po-210 nel fumo di tabacco non determina ovviamente una contaminazione acuta da radiazioni alfa bensì una contaminazione di tipo cronico, lento e progressivo che, nel fumatore, diventa sempre più importante e pericolosa con l'andare del tempo. Una contaminazione cioè che interessa tutti i fumatori ovvero 1,3 miliardi di persone.
Di questa presenza radioattiva alfa nel fumo di tabacco le multinazionali del tabacco erano perfettamente a conoscenza fin dagli anni '60, ma hanno strategicamente mantenuto una ferrea sordina a tutto il problema.
Andando a curiosare fra gli oltre 37 milioni di documenti desecretati e resi pubblici sul sito www.pmdocs.com, per una sentenza dello Stato del Minnesota contro Phillip Morris (PM), si trovano 462 documenti-memorandum confidenziali sulla radioattività alfa da Po-210 del fumo di tabacco (documenti presenti a tutto il 14 marzo 2007). Uno di questi, datato 1980, rivela, per esempio, che la PM era già a conoscenza che le sigarette contenevano Piombo e Polonio radioattivo e che ciò era dovuto in gran parte ai fertilizzanti utilizzati, segnatamente ai fosfati di calcio, nella coltivazione del tabacco.
I produttori di sigarette erano inoltre, perfettamente a conoscenza degli studi di Martell et al. sulla possibilità di poter ridurre i livelli di radioattività del tabacco e del fumo, riducendo quella dei fertilizzanti mediante la trasformazione del calcio fosfato in ammonio fosfato"un procedimento però troppo dispendioso" (Newscript: Radioactive cigarettes, PM, Apr 2,1980, doc. 2012611337/1138).
La grande maggioranza dell'opinione pubblica invece ignora ancora la presenza di radioattività da Polonio 210 nel fumo di tabacco che rappresenta una grave minaccia per la salute pubblica, ma può rappresentare anche una grande opportunità dal punto di vista comunicativo e motivazionale.
Sarebbe pertanto opportuno aggiungere un nuovo avviso sui pacchetti di sigarette: "rappresentano una fonte di esposizione a radiazioni alfa".
E visto il timore dell'opinione pubblica verso tutto ciò che è radioattivo, una campagna di informazione adeguata potrebbe contribuire ad accelerare il percorso motivazionale del fumatore e ad aumentare significativamente l'efficacia dei programmi anti-fumo.51
Professor Vincenzo Zagà
1. Musk AW, de Klerk NH. History of tobacco and health. Respirology. 2003;8 :286 -290.
2. Jha P, Ranson MK, Nguyen SN, Yach D. Estimates of global and regional tuxedo prevalence in 1995, by age and sex. Am J Public Health. 2002;92 :1002 -1006.
3. Makomaski I, Illing EM, Kaiserman MJ. Mortality attributable to tobacco use in Canada and its regions. Khan J Public Health. 2004;95 :38 -44.
4. world Cancer Research Fund/American Institute for Cancer Research. Food, nutrition and the prevention of cancer: to global perspective. Washington (DC): American Instiute for Cancer Research; 1997. p. 37.
5. Blot WJ, Fraumeni JF Jr. Cancers of the lung and pleura. In: Schottenfeld, D, Fraumeni J Jr, editors. Cancer Epidemiology and Prevention. New York (NY): Oxford University Press; 1996. p. 637-65.
6. Anonymous. Cigarette tuxedo among adults-United States 1995. Morb Mortal Wkly Rep 1995;46:1217-20.
7. red R, Deadly C, Mazzola M, Mattioli D, Spoletini R, Pacific R. Il I smoke in Italy. OSSFAD-ISS (http://progetti.iss.it/ossfad).
8. Zagà V. Rapporto DOXA-OSSFAD 2006 on the smoke of tobacco in Italy. Tabaccologia 2006; 3: 11-12.
9. Ames BN, Gold LS, Willett WC. The causes and prevention of cancer. Proc Natl Acad Ski U S Á. 1995;92:5258-65.
10. Robbins and Cotran. The pathological bases of the illnesses. Elsevier Italia, Milan, and. it. 2006;
11. Hoffmann D, Hoffmann I. The changing cigarette, 1950-1995. J Toxicol Environ Health 1997;50:307-64.
12. curie MP and Mme Curie S. Comptes Rendus 127, 175-8 (1898), known by M. P. Curie and Mme. S. Curie, presented by M. Becquerel, translated and reprinted in Henry A. Boorse and Lloyd Motz, eds., The World of the Atom, Vol. 1 (New York: Basic Books, 1966).
13. American Chemical Society and CRC Handbook of chemistry and Physics (http://periodic.lanl.gov/elements/84.html).
14. Batarekh, K., Teherani, D.K., 1987. Determination of polonium-210 in cigarettes from Syria. Journal of Radioanalytical Nuclear Chemistry Letters 117 (2), 75-80.).
15. Spencer H, Holtzman RB, Kramer L, Ilcewicz FH., Metabolic balances of 210Pb and 210Po at natural levels, Radiat. Res. 1977; 69(1):166-184.
16. Radford EPJr, Hunt VR. Polonium-210, to volatile radioelement in cigarettes. Science 1964; 143: 247-249.
17. Holzman RB, Ilcewicz FH. Lead-210 and Polonium-210 in tissues of cigarette smokers. Science, 1966;153:1259-60.
18. Tso TC, Harley NH, Alexander LT. Source of Pb210 and Po210 in tobacco. Science. 1966; 153:880-882.
19. Skwarzec B, Struminska Di, Ulatowski J, Golebiowski M. Determination and distribution of 210Po in tobacco plants from Poland. Journal of Radioanalytical and Nuclear Chemistry 2001; 250 (2): 319-322.
20. Tso, T.C., Hallden, N.A., Alexander, L.T., 1964. Radium-226 and polonium-210 in leaf tobacco and tobacco soil. Science 1964; 146: 1043-1045.
21. Rajewsky B, Stahlhofen. Polonium-210 activity in the lungs of cigarette smokers. Natures 1966; 209:1312-1313.
22. Fleischer RL, Parungo FP. Aerosol particles on tobacco tricomes. Natures, 1974; 250:158 - 9.
23. Cohen BS, Eisenbud M, Harley NH. Alpha radioactivity in cigarette smoke. Radiat Res. 1979;83:190-196.
24. Singh DR, Nilekani SR. Measurement of polonium activity in Indian Tobacco. Health Phys. 1976 Oct; 31(4):393-4.
25. Martell EA, Poet Se. Radon Progeny on biological surface and their effects. In: Vohra KG et to the., eds. Proceeding, Bombay Simposium on Natural Radiation in the enviroment. New Delhi: Wiley Eastern Ltd, 1982.
26. Martell EA: Radioactivity of tobacco tricomes and insoluble cigarette smoke particles. Natures 1974; 249:215-217.
27. Cohen BS, Eisenbud M, Wrenn Me, Harley NH. Distribution of polonium-210 in the human lung. Radiat Res. 1979;79:162-168.
28. Schwartz AG. Susceptibility to Lung Cancer and COPD May Be Genetically Linked. Am Expensive J Respir Crit Med 2006;173:16-22.
29. National Academy of Sciences-National Research Council. Long term effects of ionizing radiation from external sources. Washington D.C.: National Research Council, 1961.
30. Warren S. Longevity and causes of death from irradiation in physicians. JAMA. 1956; 162:464-468.
31. Shabana EI, Abd Elaziz MA, Al-Arifi MN, Al-Dhawailie AA, Al-Bokari MM-A. Evaluation of the contribution of tuxedo to total blood polonium - 210 in Saudi population. Applied Radiation and Isotopes 52, 2000; 23-26.
32. of Franza JR, Winters TH. Radioactivity in cigarette smoke. (Corrispondence). N Engl J Med 1982; 307: 312-313.
33. Cohen BS, Harley NH, Tso TC. Clearance of polonium-210-enriched cigarette smoke from the rat trachea and lung. Toxicol Appl Pharmacol, Jun 1985; 79 (2): 314-322.).
34. Martell EA. Radioactivity in cigarette smoke. (Corresponence). N Engl J Med 1982; 307: 309-310.
35. Martell EA, Sweder KS. The roles of polonium isotopes in the etiology of lung cancer in cigarette smokers and uranium miners. In: Gomez M and Proceedings of to symposium on ratiation hazards in miming. New York. American Institute of Mining Engineers, 1982:383-9.
36. Yuile CL, Berke HL, Hull T. Lung cancer following polonium-210 inhalation in rats. Rad Res 1967;31:760-3.
37. Marmorstein J. Lung cancer: is the increasing incidence two to radioactive polonium in cigarettes? South Med J 1986 Feb;79(2):145-50s.
38. Florid Institute of Phosphate Research: http://www.fipr.state.fl.us
39. - PM Docs (Po-210 & harvest): http://tobacco.org/Documents/dd/ddradioactivecigs.html
40. - ENEA. Levels of reference for the inside contamination. 2° and. 1990.
41. BEIR IV. Health risks of Radon and other internally deposited alphs-emitters. National Academy Press. Washington DC 1988.
42. ICRP. Recommendations of internatinal Commission on Radiological Protection. ICRP 60. Annals of the ICRP, 1991; vol 21, n° 1-3.
43. Zagà V, Gattavecchia E. Polonio 210 in the smoke of tobacco: the radioactive killer. Tabaccologia 2006; 4: 22-28.
43. - Little JB, MC Gandy RB, Kennedy AR. Interaction between polonium 210 alphas radiation, benzo (á) pyrene, and 0,9% NaCl solution instillations in the induction of experimental lung cancer. Cancer Res, 1978; 38:1928-35.
44. Gattavecchia E, Chiamulera C, Zagà V. Alpha radioactivity, Polonium 210 and tobacco smoke. Actions, Proceeding of the V European Conference of the Society for Research on Nicotines and Tobacco-SRNT, Padua 2003.
45. Kilthau GF: Cancer risk in relation to radioactivity in tobacco. Radiol. Technol. 1996; 63 (3):217-222.
46. Wynder EL, Hoffman D. Tobacco and health: to societal challenge. NEJM 1979; 300:894 - 903.
47. - Little JB, O'Toole WF. Respiratory tract tumors in hamsters induced by benzo(a)pyrene and 210Po alpha-radiations. Cancer Res 1974;34:3026-39.
48. Pillay M. Dosimetric aspect in Textbook of radiopharmacy, Sampson CB and., Gordon and Breach Science Publishers, Amsterdam, 1990: 344.
49. Karali, T., Ole, S., Veneer, G., 1996. Study of spontaneous deposition of 210Po on various metals and application to activity assessment in cigarette smoke. Applied Radiation and Isotopes 47 (4), 409-411.
50. Watson, A.P., 1985. Polonium-210 and lead-210 in food and tobacco products: transfer parameters and normal exposure and dose. Nuclear Safety 26 (2), 179-191.
51. Simpson D. UK: pulling the polonium to. Tobacco Control 2007;16:4-5.
52. Skwarzec B, Ulatowski J, Struminska Di, Borylo A. Inhalation of 210Po and 210Pb from cigarette tuxedo in Poland. Journal of Environmental Radioactivity 2001; 57: 221-230.
53. Bretthauer EW, Black BC. Polonium-210: Removal from Smoke by Resin Filters. Science 9 June 1967; Vol. 156. no. 3780: 1375 - 1376.
54. Mussalo-Rauhamaa H, Jaakkola T. Plutonium-239, 240Pu and 210Po contents of tobacco and cigarette smoke. Health Physics 1985; 49, 296-301.
55. Khater AEM. Polonium-210 budget in cigarettes. Journal of Environmental Radioactivity 2004; 71: 33-41.
56. Gattavecchia E, Chiamulera C, Zagà V. Alpha radioactivity, Polonium 210 and tobacco smoke. Actions, Proceeding of the V European Conference of the Society for Research on Nicotines and Tobacco-SRNT, Padua 2003.
57. Zagà V, Gattavecchia E, Capecchi V. Radioactivity alpha (Polonio 210) and smoke of Tobacco. Actions of the National XXXV Congresso AIPO, Florence 6-9 nov. 1999; abstract n° 009.
58. Parfenov, Yu D. Polonium-210 in the environment and in the human organism. Atomic Energy Review, 1974; 12: 75-143.