da Leadership Medica n.2 del 2001
ABSTRACT
Pier Mario Biava, Daniele Bonsignorio, Mirjam Hoxha, Alberto Frosi, Monica Impagliazzo
Cinque linee cellulari di tumori umani di diversa origine (glioblastoma, melanoma, adenocarcinoma del rene, carcinoma della mammella e leucemia linfoblastica) sono state trattate in vitro con estratti di embrione di zebrafish prelevati a quattro diversi stadi di sviluppo. Tutte le linee cellulari hanno risposto con un notevole rallentamento della proliferazione se trattate con gli estratti prelevati durante gli stadi di differenziazione cellulare, mentre non si è osservato alcun rallentamento quando sono state trattate con estratto prelevato durante uno stadio meramente moltiplicativo. Tali risultati suggeriscono che una complessa rete di fattori molecolari durante la differenziazione embrionale possa aiutare cellule proliferanti in modo anomalo a normalizzare il proprio ciclo, e che la somministrazione di fattori di differenziazione delle cellule embrionali possa essere un utile strumento nella terapia contro il cancro. D’altro canto è risaputo che le cellule staminali possono differenziarsi in diversi tipi di cellule, a seconda dei diversi tipi di microambiente embrionale. Dal momento che questa rete di fattori di differenziazione cellulare può normalizzare l’espressione alterata dei geni, suggeriamo che essa rappresenti una terapia genica fisiologica.
Introduzione
 Le prove ottenute dallo studio delle interazioni fra tessuti embrionali e cellule tumorali suggeriscono che la crescita tumorale venga soppressa quando i tumori sono trattati con estratti embrionali prelevati durante l’organogenesi. Infatti si è dimostrato che la crescita del tumore primitivo e la formazione delle metastasi polmonari in topi singeneici C57BL/6 cui erano state inoculate 1x106 cellule del carcinoma polmonare di Lewis sono state fortemente rallentate quando i topi sono stati trattati con estratti di utero gravido o estratti di embrioni presi nei primi stadi dell’organogenesi (1,2,3). Più precisamente è stato dimostrato che la crescita anomala di cloni cellulari durante l’organogenesi embrionale nei mammiferi viene contrastata da sostanze a basso peso molecolare presenti nel microambiente dell’utero gravido. Esperimenti precedentemente eseguiti nel nostro laboratorio avevano dimostrato che estratti di utero di topo gravido sono in grado di inibire la crescita delle cellule del carcinoma polmonare di Lewis in vivo (1). Inoltre, esperimenti più recenti in vitro hanno dimostrato che estratti di utero gravido di maiale e di topo rallentano il tasso di proliferazione di diverse linee cellulari stabilizzate di tumori umani (4). Pertanto, l’interazione fra madre ed embrione sembra essere importante ai fini dello sviluppo normale e della prevenzione della crescita cellulare patologica. L’embrione stesso sembra contrastare la moltiplicazione anomala di cellule tumorali. Il concetto che lo sviluppo embrionale e la genesi dei tumori siano strettamente correlati è un fatto ormai accettato: i due processi hanno in comune diversi percorsi e molecole regolatrici, per cui il cancro può essere visto come una deviazione evolutiva suscettibile di controllo da parte dei regolatori della differenziazione cellulare (5,6). L’effetto principale del trattamento in vitro delle linee cellulari tumorali con estratti di embrioni di ovipari è l’attivazione dell’espressione di p53, quale osservata con il metodo immunoistochimico e citofluorimetrico dopo il trattamento di linee cellulari di glioblastoma, melanoma ed epatocarcinoma con estratti di embrioni di pesce (7). Al fine di stabilire se tali estratti di embrione influiscano sulla proliferazione delle cellule tumorali, il presente lavoro è finalizzato a stabilire gli effetti in vitro di estratti di embrioni di zebrafish in quattro distinti stadi di sviluppo sulla crescita di cinque linee cellulari tumorali.
Le prove ottenute dallo studio delle interazioni fra tessuti embrionali e cellule tumorali suggeriscono che la crescita tumorale venga soppressa quando i tumori sono trattati con estratti embrionali prelevati durante l’organogenesi. Infatti si è dimostrato che la crescita del tumore primitivo e la formazione delle metastasi polmonari in topi singeneici C57BL/6 cui erano state inoculate 1x106 cellule del carcinoma polmonare di Lewis sono state fortemente rallentate quando i topi sono stati trattati con estratti di utero gravido o estratti di embrioni presi nei primi stadi dell’organogenesi (1,2,3). Più precisamente è stato dimostrato che la crescita anomala di cloni cellulari durante l’organogenesi embrionale nei mammiferi viene contrastata da sostanze a basso peso molecolare presenti nel microambiente dell’utero gravido. Esperimenti precedentemente eseguiti nel nostro laboratorio avevano dimostrato che estratti di utero di topo gravido sono in grado di inibire la crescita delle cellule del carcinoma polmonare di Lewis in vivo (1). Inoltre, esperimenti più recenti in vitro hanno dimostrato che estratti di utero gravido di maiale e di topo rallentano il tasso di proliferazione di diverse linee cellulari stabilizzate di tumori umani (4). Pertanto, l’interazione fra madre ed embrione sembra essere importante ai fini dello sviluppo normale e della prevenzione della crescita cellulare patologica. L’embrione stesso sembra contrastare la moltiplicazione anomala di cellule tumorali. Il concetto che lo sviluppo embrionale e la genesi dei tumori siano strettamente correlati è un fatto ormai accettato: i due processi hanno in comune diversi percorsi e molecole regolatrici, per cui il cancro può essere visto come una deviazione evolutiva suscettibile di controllo da parte dei regolatori della differenziazione cellulare (5,6). L’effetto principale del trattamento in vitro delle linee cellulari tumorali con estratti di embrioni di ovipari è l’attivazione dell’espressione di p53, quale osservata con il metodo immunoistochimico e citofluorimetrico dopo il trattamento di linee cellulari di glioblastoma, melanoma ed epatocarcinoma con estratti di embrioni di pesce (7). Al fine di stabilire se tali estratti di embrione influiscano sulla proliferazione delle cellule tumorali, il presente lavoro è finalizzato a stabilire gli effetti in vitro di estratti di embrioni di zebrafish in quattro distinti stadi di sviluppo sulla crescita di cinque linee cellulari tumorali.
Materiali e Metodi
Estratti di embrioni di zebrafish
Embrioni di zebrafish ai seguenti stadi di sviluppo:
- a) circa 1000 blastomeri;
- b) epibolia 50%;
- c) 5 somiti e
- d) 20 somiti sono stati raccolti e dissolti con un turboemulsionatore PBS a freddo.
Gli estratti, denominati rispettivamente “stadio 1k”, “stadio I”, “stadio II” e “stadio III”, sono stati preparati alla diluizione di 1 mg/ml in una soluzione glicero-alcolica così costituita: 85 % di glicerolo e 15 % di etanolo assoluto, e conservati a 4°C fino al momento dell’uso. Coltura e trattamento delle linee cellulari tumorali con estratti di embrioni di zebrafish Sono state ottenute dall’Istituto Zooprofilattico Sperimentale di Brescia linee cellulari tumorali umane di A172 (glioblastoma), A375 (melanoma), ACHN (adenocarcinoma del rene), ZR75.1 (carcinoma della mammella) e H9 (leucemia linfoblastica), successivamente ampliate nel nostro laboratorio. Tutte le cellule sono state coltivate in terreno di coltura integrato con siero fetale (10%), 1 mM di Na-piruvato, 2 mM di L-Glutammina ed antibiotici Penicillina/ Streptomicina. I terreni di coltura Eagle’s MEM, Dulbecco’s MEM e RPMI1640, l’Na-piruvato, la L-Glutammina, gli antibiotici ed il PBS sono stati acquistati presso Labtek Eurobio; i sieri fetali sono stati acquistati presso Celbio. Al fine di stabilire quali diluizioni dei solventi di glicerolo ed alcol fossero senza effetti, sono state eseguite analisi preliminari di proliferazione cellulare dopo aver trattato le linee cellulari con diverse diluizioni di soluzione glicero-alcolica pura (dati non mostrati). Abbiamo osservato che il tasso di proliferazione cellulare in una diluizione 1:50 di soluzione glicero-alcolica non differiva in modo significativo da quello di cellule coltivate in un normale mezzo di coltura. Tutte le linee cellulari sono state piastrate in capsule di petri di 60 mm di Ø, eccetto le cellule H9, che sono state piastrate in fiasche da 25 mm. Dopo il piastramento, si sono lasciate crescere tutte le cellule per 24 ore prima del trattamento. I trattamenti sono stati eseguiti tramite l’aggiunta alle cellule di estratti di embrioni di zebrafish in una diluizione di 1:50 di terreno di coltura fresco. Il quantitativo totale di proteine per trattamento è stato di 100 ng. Il conteggio delle cellule è stato eseguito manualmente tramite il metodo del trypan blu a 0, 24 e 48 ore dal trattamento. Per ciascun esperimento sono stati eseguiti 10 conteggi per trattamento. Ciascun esperimento è stato ripetuto più volte.
Risultati
La figura 1 mostra che le curve di proliferazione cellulare sono state considerevolmente rallentate nelle cellule di glioblastoma A172 dopo il trattamento con gli estratti di embrioni di zebrafish allo stadio I, II e III, ove lo stadio I si è dimostrato il più efficace.
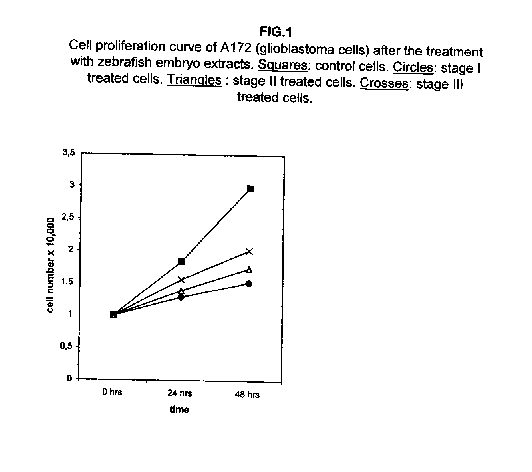
Un notevole rallentamento è già visibile a 24 ore dal trattamento con tutti e tre gli estratti, con un aumento a 48 ore. Nelle cellule di melanoma A375, la proliferazione a 24 ore dal trattamento mostra un effetto minore, ma l’effetto dopo 48 ore si dimostra anch’esso significativo (figura 2).
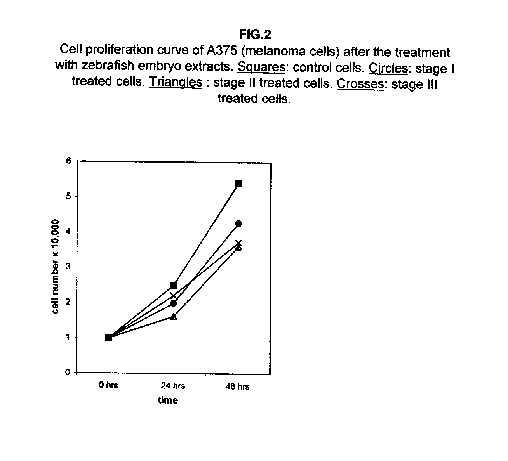
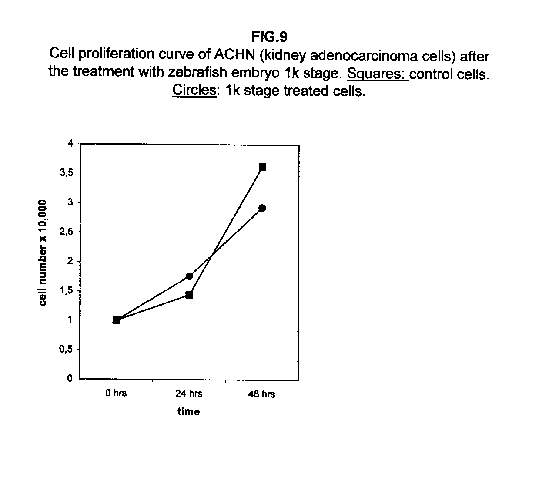
Gli estratti allo stadio II e III sono i più efficaci. Nelle cellule trattate di adenocarcinoma ACHN del rene, non si osserva alcun effetto sulla crescita a 24 ore dal trattamento rispetto alle cellule di controllo, ma tutti e tre gli stadi determinano un rallentamento nella proliferazione cellulare a 48 ore dal trattamento (figura 3).
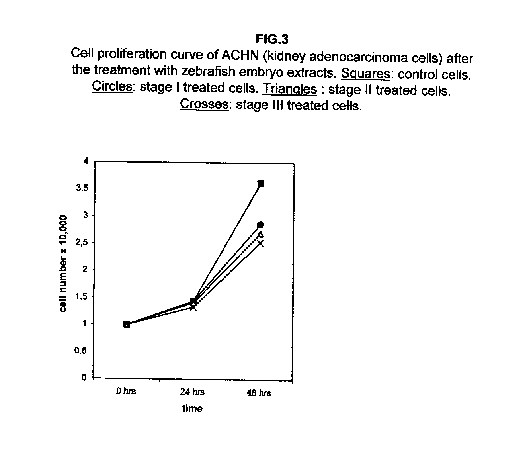
Nelle cellule ZR.75.1 del carcinoma della mammella, il I stadio ha un effetto pressoché bloccante sulla crescita cellulare, mentre le curve di proliferazione delle cellule trattate con gli stadi II e III dopo 24 ore mostrano un calo, il che suggerisce che possa aver luogo una soppressione di cellule piuttosto che un meccanismo di rallentamento della crescita (figura 4).
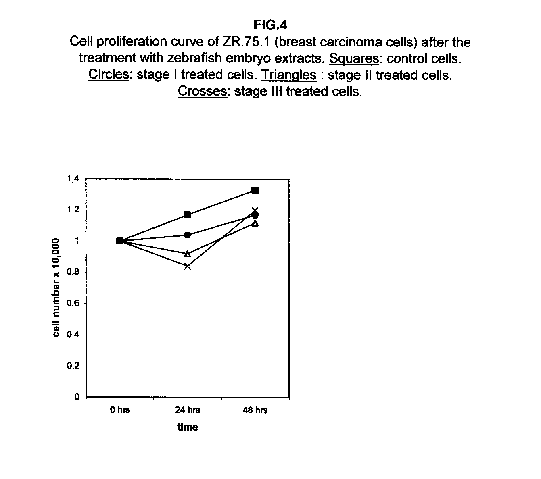
A 48 ore dal trattamento, tuttavia, i valori di proliferazione per lo stadio II e III crescono, avvicinandosi a quelli delle cellule trattate con lo stadio I. I tassi di proliferazione delle cellule H9 trattate con tutti e tre gli stadi si sono rivelati pressoché bloccati a 48 ore dal trattamento (figura 5).
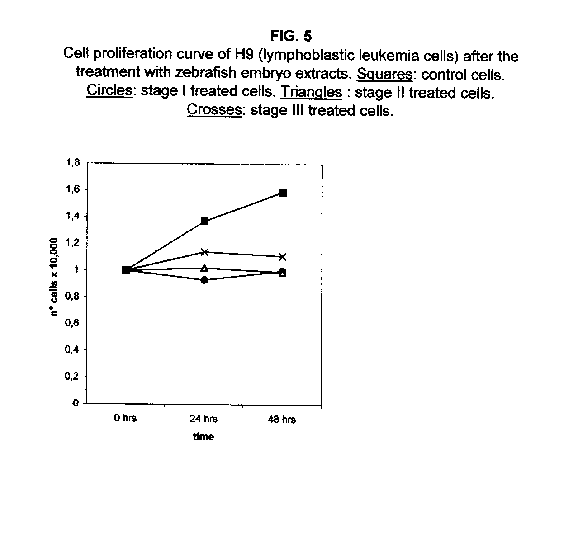
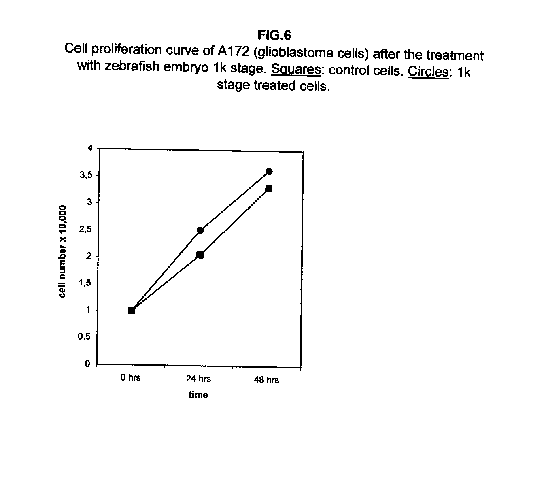
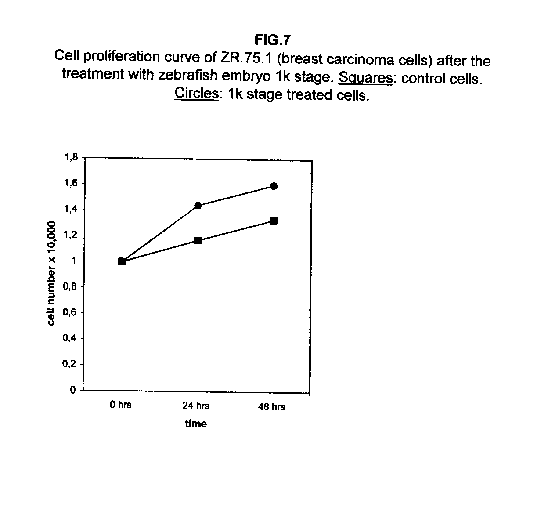
Il trattamento di tutte le linee cellulari con uno stadio meramente proliferativo, più precisamente lo stadio 1k, ha dimostrato che in tutti i casi la proliferazione era equivalente a quella delle cellule di controllo, se non superiore. Nelle cellule A172 e ZR.75.1, il tasso di proliferazione delle cellule trattate con lo stadio 1k si è dimostrato più veloce sia a 24 che a 48 ore dal trattamento (figure 6 e 7).
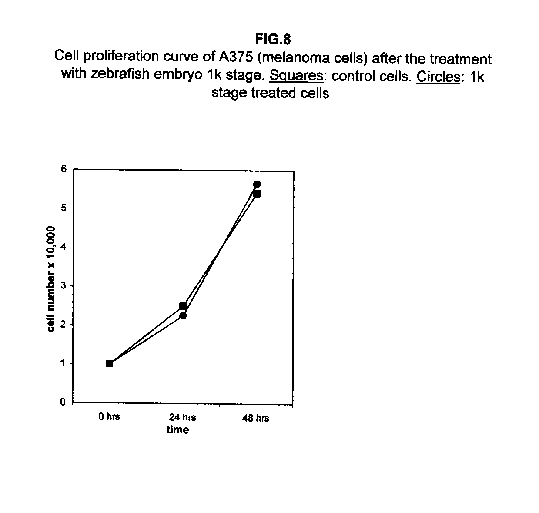
Nelle cellule A375, le due curve quasi collidono (figura 8), mentre le cellule ACHN hanno dimostrato un comportamento intermedio, con valori di proliferazione per le cellule trattate con lo stadio 1k più alti rispetto alle cellule di controllo a 24 ore dal trattamento e più bassi a 48 ore (figura 9).
Discussione
I nostri risultati dimostrano che molecole presenti durante alcuni stadi decisivi della differenziazione embrionale sono in grado di rallentare la crescita di diverse linee cellulari tumorali in vitro. 48 ore dopo il trattamento tutte le linee cellulari analizzate hanno mostrato una notevole riduzione della curva di proliferazione. La linea cellulare di leucemia linfoblastica (H9) è quella che ha mostrato la risposta più forte a tutti e tre gli stadi di differenziazione (I, II, III), con un arresto pressoché completo della proliferazione. Si è osservato che l’effetto rallentante degli estratti variava a seconda della linea cellulare analizzata: fatta eccezione per le cellule di H9, le linee cellulari più sensibili si sono dimostrate quelle di glioblastoma A172 e quelle del carcinoma della mammella ZR.75.1, che già mostravano una risposta significativa a 24 ore dal trattamento. La linea cellulare del melanoma A375 ha dimostrato una risposta leggermente più debole, mentre il trattamento si è dimostrato efficace sul tasso di proliferazione delle cellule di adenocarcinoma del rene ACHN soltanto dopo 48 ore. Tali risultati suggerirebbero che non tutti i tipi di tumore rispondano allo stesso modo al trattamento con estratti di embrione. In ogni caso, i valori percentuali di rallentamento rilevati a 48 ore dal trattamento non sono stati mai inferiori al 25 %. Mentre lo stadio III (pari ad uno sviluppo di 24 ore) ha avuto un effetto pressoché uniforme su tutte le cellule tumorali (con una percentuale di rallentamento compresa fra il 49 % nelle cellule di A172 ed il 39 % nelle cellule di ZR.75.1 e A375), gli effetti rallentanti degli stadi I (stadio evolutivo con epibolia 50%, corrispondente all’ inizio della gastrulazione) e II (stadio evolutivo a 5 somiti) si sono rivelati più fluttuanti, sebbene più marcati: la percentuale rallentante dello stadio I mostra una punta del 74 % nelle cellule di A172, mentre la percentuale rallentante dello stadio II raggiunge il 67% nelle cellule di ZR.75.1 ed il 63% nelle cellule di A172. D’altra parte, le molecole estratte in uno stadio meramente moltiplicativo, quale lo stadio 1k (stadio di segmentazione), non hanno alcun effetto sulla proliferazione delle cellule tumorali. Pertanto, la differenziazione cellulare costituisce un processo chiave per la comprensione del comportamento delle cellule sia normali che tumorali. Il genoma della cellula tumorale contiene in genere un numero estremamente alto di geni alterati, la maggior parte dei quali svolge, quando normali, un ruolo importante nello sviluppo dell’embrione. Infatti, durante la genesi dei tumori, vengono attivati o mutati alcuni geni embrionali (proto-oncogeni e oncogeni), il che porta la cellula ad un programma di moltiplicazione incontrollata. E’ probabile che nelle cellule tumorali venga interamente o parzialmente disattivato il programma della differenziazione cellulare. Pertanto, le cellule tumorali possono essere considerate cellule che condividono configurazioni geniche simili a quelle delle cellule di embrioni in fase evolutiva. In effetti, è risaputo che le cellule tumorali e quelle embrionali condividono alcuni antigeni superficiali. Proprio di recente è stato scoperto un nuovo antigene carboidratico condiviso da svariate linee cellulari tumorali e dall’embrione di Xenopus laevis (8,9). Secondo questo punto di vista, il box 1 descrive un modello di differenziazione cellulare che predice il numero complessivo dei diversi tipi di cellule completamente differenziate ed il numero dei diversi tipi di tumore. In base a tale modello, se ricordiamo che le cellule embrionali si moltiplicano fra due stadi di differenziazione, possiamo considerare le cellule tumorali come cellule embrionali mutate nelle quali i programmi di moltiplicazione e di differenziazione cellulare non sono più correttamente abbinati. Pertanto esse si comportano come un computer andato in loop, limitandosi a ripetere il programma di moltiplicazione. Più precisamente le cellule tumorali si possono considerare, tenendo presente il modello presentato nel Box 1, come cellule staminali mutate (9 tipi nel modello riportato), come cellule staminali determinate o “committed” mutate (27 tipi), o come cellule mutate in fase di differenziazione definitiva (81 tipi), in ragione del loro grado di malignità. I fattori presenti nei tessuti embrionali in fase di differenziazione sono in grado di ristabilire le condizioni originarie, normalizzando e differenziando le cellule mutate indifferenziate. E’ possibile che tale differenziazione coinvolga direttamente regolatori e geni chiave del ciclo cellulare. In genere tali regolatori sono organizzati in una rete o costituiscono una famiglia di sostanze simili che collaborano in complesse funzioni a cascata. E’ probabile che la moltiplicazione delle cellule tumorali possa essere controllata solo quando questa rete è completa. Infatti, sulla base di un modello di complessità, una o poche molecole contribuiscono solo in modo modesto a fornire informazioni utili alla regolazione delle complesse alterazioni geniche che hanno luogo nelle cellule tumorali. La somma di tutti i fattori che circondano la cellula è il microambiente, che riveste un ruolo decisivo nella regolazione della moltiplicazione e della differenziazione delle cellule, sia normali che tumorali. L’embrione possiede il microambiente più efficace, in grado di indirizzare le cellule staminali ad una completa differenziazione (10,11, 12). D’altro canto, è risaputo che il microambiente embrionale è in grado di differenziare le cellule staminali in modi diversi. E’ stato infatti dimostrato che le cellule staminali possono essere differenziate in diversi tipi di cellule a seconda dei diversi tipi di fattori: ad esempio, le cellule staminali neurali possono essere differenziate in cellule della linea ematopoietica se messe in contatto con il microambiente che differenzia le cellule ematiche (13), o in cellule muscolo-scheletriche se messe in contatto con fattori della differenziazione muscolo-scheletrica (14). Gli stessi risultati si ottengono con cellule staminali epatiche. (15). Studi precedenti (7) hanno dimostrato che estratti embrionali prelevati durante stadi di differenziazione cellulare sono in grado di attivare l’espressione del gene soppressore dei tumori p53 in diverse linee cellulari tumorali. L’attivazione di p53 potrebbe essere funzionalmente collegata al rallentamento del tasso di proliferazione delle cellule tumorali, come osservato in questo lavoro, sebbene non sia possibile escludere il coinvolgimento di altri componenti del ciclo cellulare. Al momento stiamo conducendo esperimenti per chiarire il ruolo di pRb in questa regolazione. pRb sembra essere regolato dagli estratti embrionali: è pertanto possibile che il rallentamento delle curve di proliferazione delle cellule tumorali sia da ascrivere ad una regolazione multi-genica (dati non ancora pubblicati). Stiamo altresì studiando il ruolo della telomerasi sull’osservato rallentamento delle curve di proliferazione delle cellule tumorali dopo il trattamento con estratti embrionali. Infatti è noto che le cellule differenziate contengono un livello più basso di telomerasi rispetto alle cellule staminali. I primi esperimenti sembrano dimostrare che il trattamento con estratti embrionali possa ridurre il livello di telomerasi nelle cellule tumorali. Sappiamo, in base alla bibliografia, che la creazione di cellule tumorali umane con elementi genetici definiti implica proprio p53, pRb e telomerasi (16). Pertanto il trattamento con i regolatori della differenziazione cellulare non solo è in grado di differenziare le normali cellule staminali, ma probabilmente anche le cellule staminali mutate, by-passando le mutazioni che danno origine alla malignità. In ogni caso, il trattamento di pazienti affetti da cancro con estratti embrionali prelevati durante stadi specifici della differenziazione cellulare, che non siano di moltiplicazione cellulare, potrebbe rappresentare un promettente nuovo strumento terapeutico. Potrebbe essere anche considerata una terapia genica fisiologica economica ed innocua, priva dei vari svantaggi della terapia genica tradizionale.
Pier Mario Biava
Fondazione per la Ricerca delle Terapie Biologiche del Cancro.
Ospedale Civile Sesto San Giovanni - Milano
Bibliografia
1) Biava PM, Fiorito A, Negro C, Mariani M: Cancer Letter 41, 265-270 (1988)
2) Biava PM, Carluccio A : La Medicina Biologica 2-4 (1994)
3) Biava PM, Carluccio A : Biol Medizin 5: 247-249 (1995)
4) Biava PM, Bonsignorio D, Hoxha M : J Tumor Marker Oncol: 15:223-233 (2000)
5) Zhang P : Curr Opin Cell Biol 11: 655–662 (1999)
6) Potter CJ, Turenchalk GS, Xu T : Trends Genet 16: 33-39 (2000)
7) Biava PM, Carluccio A : J Tumor Marker Oncol 12: 9-15 (1997)
8) Klavins JV, Sell S, Fuchs A : J Tumor Marker Oncol 11: 36 (1996)
9) Zhang S, Sell S, Livingston PO, Klavins JV : J Tumor Marker Oncol 12: 52 (1997)
10) Stewart TA, Mintz B: Proc Natl Acad Sci USA 78: 6314-6318 (1981)
11) Feijen A, Goumans MJ, Van den Eijnden-van Raaij AJ: Development 120: 3621-3637 (1994).
12) Andrews PW, Damjanov I, Berends J, Kumpf S, Zappavigna V, Mavilio F, Sampath K : Lab Invest 71(2): 243-251 (1994).
13) Bjornson CR, Rietze RL, Reynolds BA, Magli MC, Vescovi AL : Science 283 (5401): 534–537 (1999).
14) Galli R, Borello U, Gritti A, Minasi MG, Bjornson C, Coletta M, Mora M, De Angelis MG, Fiocco R, Cossu G, Vescovi AL: Nat Neurosci 3(10): 986-991 (2000).
15) Sell S : Cellular origin of liver stem cells. 16th Int. Conf. on Human Tumor Markers, Budapest, June 13-16 (1999).
16) Hahn W.C. Nature Vol. 400 (1999)




