da Leadership Medica n. 7 del 2007
Abstract
L'indicazione chirurgica negli aneurismi dell'aorta addominale (AAA) dipende da numerosi fattori di ordine locale e soprattutto generale, ma vi è un consenso generale sulla necessità di operare gli AAA asintomatici di diametro superiore a 5 cm. L'intervento tradizionale consiste nel praticare, in anestesia generale e attraverso una via laparotomica mediana xifo-pubica, l'endoaneurismectomia con innesto protesico in genere in dacron knitted. E' un intervento di alta chirurgia con una morbilità e mortalità attorno al 3% e con decorso post-operatorio abbastanza gravoso.
Per migliorare i risultati e per avere un decorso meno impegnativo, si sono impiegate endoprotesi aortiche che vengono introdotte per via inguinale in anestesia spinale, oppure si è utilizzata una terza via e cioè la chirurgia aortica miniinvasiva che può trattare gli AAA mediante una minilaparotomia e la videolaparoscopia.
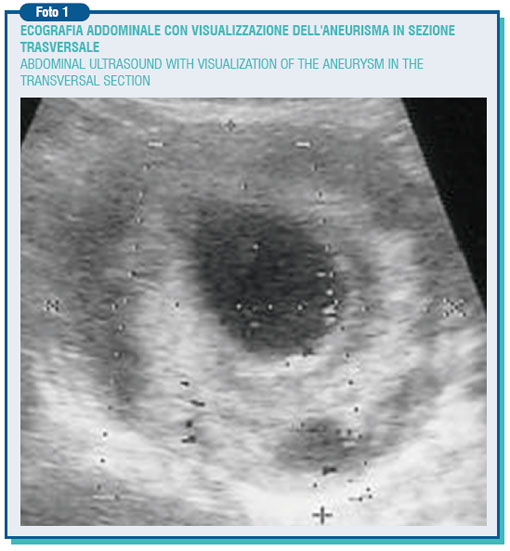
Per aneurisma si intende la dilatazione permanente e focale di un'arteria con un incremento del diametro di almeno il 50% rispetto al suo diametro normale.
Tale dilatazione è dovuta ad una alterazione della struttura dell'arteria, con interruzione parziale delle sue componenti elastiche e muscolari. La dilatazione comporta inevitabilmente la formazione di turbolenze associate ad un rallentamento del flusso ematico che provoca una trombosi parietale con la contemporanea conservazione del lume reale. L'eziopatogenesi degli aneurismi è probabilmente multifattoriale, ma la malattia aterosclerotica rappresenta la causa principale.
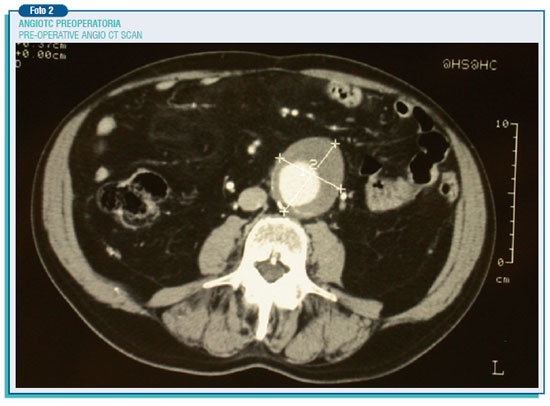
Più del 90% degli aneurismi dell'aorta addominale (AAA) infatti hanno una natura aterosclerotica. La sede principale degli AAA è situata sotto l'emergenza delle arterie renali e in genere si estendono fino alla biforcazione dell'aorta. La loro frequenza, soprattutto nel sesso maschile, è in continuo aumento per la diffusione della malattia aterosclerotica, l'aumento dell'età media e anche per lo sviluppo delle tecniche diagnostiche non invasive quali l'ecografia, l'ecocolor Doppler, che dovrebbero diventare esami di screening nella popolazione al di sopra dei 65 anni. L'aorta addominale sottorenale ha un diametro trasverso di circa 2 cm., che varia però con l'età, il peso e l'area di superficie corporea. Allorché il diametro è maggiore, si parla di ectasia, cioè di dilatazione, e solo dopo i 3,5-4 cm di aneurisma. L'aneurisma è in genere asintomatico ma, quale conseguenza della progressiva espansione (aumento di 0.3-0.4 cm/anno), la sua tendenza evolutiva va verso la rottura che può essere improvvisa. Il rischio di rottura aumenta con il diametro dell'AAA: 4.1% sotto i 5 cm, 6.6% tra 5 e 7 cm e 19% sopra i 7 cm. L'aneurisma rotto ha una mortalità che arriva addirittura al 94%, se vengono conteggiati anche i decessi avvenuti prima del ricovero in ospedale. Si tratta in ogni caso di un evento estremamente drammatico che, anche nei sopravvissuti, comporta spesso una lunga convalescenza con riduzione della qualità della vita per le numerose e diverse complicanze che possono presentarsi. Vi è quindi un consenso generale sulla necessità di operare gli aneurismi asintomatici di diametro superiore ai 5 cm anche perché la mortalità operatoria è del 3% circa, mentre le opinioni sono contrastanti per quanto riguarda l'indicazione chirurgica nei cosiddetti piccoli aneurismi di diametro inferiore ai 5 cm.
Certamente l'indicazione chirurgica dipende da numerosi fattori di ordine locale quali l'accrescimento rapido e superiore a 0.5 cm l'anno, la presenza di blisters (espansioni localizzate facili a rompersi) e soprattutto fattori di ordine generale quali l'insufficienza cardiorespiratoria, l'insufficienza renale, una spettanza di vita inferiore ai 2 anni, l'associazione di lesioni coronariche o carotidee.
Il primo intervento è stato praticato da Dubost il 23.03.1951, ma la tecnica che viene universalmente eseguita è quella introdotta da Creech nel 1966 e cioè non la resezione dell'aneurisma come se fosse un tumore da asportare, ma l'endoaneurismectomia con innesto alloplastico ossia protesico.
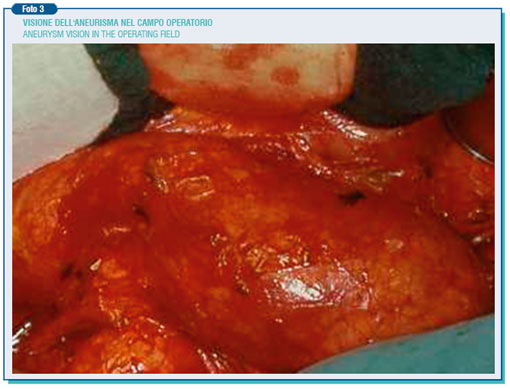
Attraverso una laparotomia mediana xifo-pubica, in anestesia generale, si isola la faccia anteriore e laterale sinistra dell'aneurisma estendendosi verso l'alto fino a reperire e isolare il colletto dell'aneurisma e cioè il tratto di aorta situato sotto l'emergenza delle arterie renali dove il diametro è pressoché normale. Particolare attenzione deve essere posta alla dissecazione del plesso nervoso preaortico durante l'isolamento della biforcazione aortica e soprattutto dell'iliaca comune sinistra, in quanto la lesione del plesso può provocare una disfunzione sessuale caratterizzata da una eiaculazione retrograda
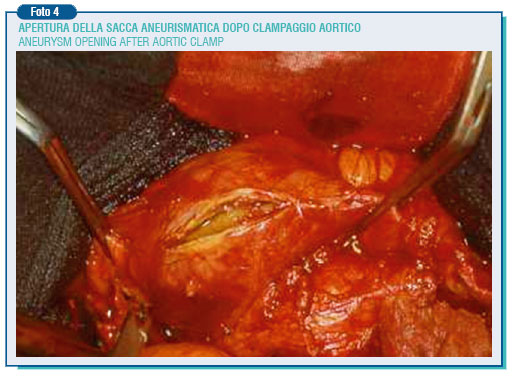
A valle dell'aneurisma ed a seconda della sua estensione è necessario isolare le iliache comuni oppure le iliache esterne ed interne. Sul lato sinistro dell'aneurisma viene isolata l'arteria mesenterica inferiore. Se essa è pervia bisogna valutare la presenza o meno di un segnale Doppler sul colon sigmoideo dopo il suo clampaggio: la scomparsa del segnale rende necessario il reimpianto della mesenterica sulla protesi per evitare la comparsa di lesioni ischemiche intestinali. Previa eparinizzazione per via generale, si esegue il clampaggio a monte e a valle e si incide l'aneurisma lungo la sua faccia laterale sinistra, asportando il contenuto costituito da coaguli e materiale necrotico e suturando dall'interno gli ostii sanguinanti delle arterie lombari e della sacrale media. Si sceglie quindi la protesi, retta o biforcata, di calibro lievemente inferiore a quello del colletto aortico per la possibilità di una dilatazione futura. Sono protesi di 16-18 mm., in Dacron woven o knitted, impregnate con albumina o collagene o gelatina che non richiedono precoagulazione.
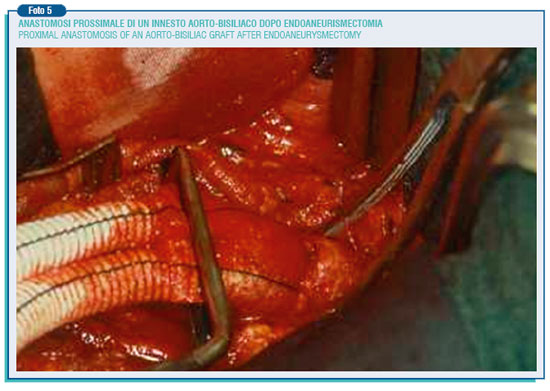
Le anastomosi prossimale e distale vengono eseguite termino-terminalmente. Alla fine la parete dell'aneurisma viene suturata attorno alla protesi per evitare il contatto diretto della protesi con il duodeno e quindi la possibilità di una fistola aorto-enterica. Come abbiamo detto, la mortalità operatoria è attorno al 3%, ma l'intervento descritto ha una discreta gravità, soprattutto in quei pazienti definiti per le loro condizioni generali "ad alto rischio chirurgico". L'incisione chirurgica estesa longitudinalmente a tutto l'addome, la presenza di un sondino naso-gastrico per 2-3 giorni fino alla ripresa della canalizzazione intestinale, il catetere vescicale fanno si che il decorso post-operatorio sia piuttosto doloroso ed impegnativo. Inoltre il paziente deve rimanere ricoverato 5-7 giorni. Proprio per ottenere una riduzione della mortalità e della morbilità e un decorso post-operatorio meno grave, si stanno sempre più diffondendo le endoprotesi aortiche dopo il 1° intervento eseguito da Parodi nel 1991.
Il trattamento con endoprotesi viene proposto innanzitutto per pazienti con problemi di accesso chirurgico (addome ostile) o ad alto rischio chirurgico oppure in pazienti anziani con favorevole configurazione anatomica dell'aneurisma. Quest'ultimo problema concerne soprattutto il colletto aortico per le sue caratteristiche anatomiche e parietali e per la sua possibile tendenza alla dilatazione.
Le endoprotesi di nuova generazione danno risultati decisamente migliori grazie alla migliorata progettazione bioingegneristica, con la possibilità di disporre di agganci sovrarenali, di una struttura modulare, della disponibilità di extender cuffs e di una miniaturizzazione dei devices di rilascio.
Le endoprotesi vengono introdotte per via inguinale attraverso le arterie femorali, senza dover aprire l'addome e per lo più l'intervento può essere praticato in anestesia spinale.
La mortalità operatoria degli interventi endovascolari è stimata attorno al 1%, il decorso post-operatorio è poco doloroso ed impegnativo e il paziente può essere dimesso dopo 1-2 giorni.
La chirurgia endovascolare è estremamente vantaggiosa, come proposta terapeutica, soprattutto nei pazienti ad alto rischio. In questi soggetti, identificabili per l'età > di 70 anni, la presenza di almeno un fattore di co-morbilità (scompenso cardiaco sintomatico, patologia valvolare cardiaca, aritmia cardiaca, insufficienza respiratoria o insufficienza renale cronica) e un diametro dell'aneurisma di almeno 5,5 cm, la correzione endovascolare consente, secondo i dati recentemente presentati nello studio EVAR2, di abbassare la mortalità peri-operatoria dal 5,1% della chirurgia aperta al 2,9%.

Tuttavia nel follow-up l'aneurisma può non ridursi di dimensioni o addirittura aumentare e questo per i problemi legati agli endoleak e all'endotension.
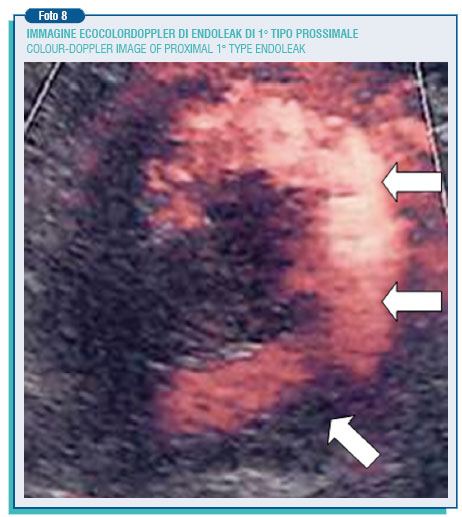
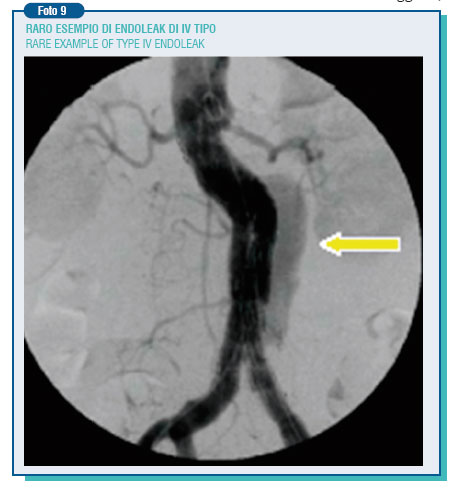
E' definito endoleak la persistenza di flusso ematico nello spazio compreso tra l'endoprotesi e la parete aortica. La persistenza di flusso comporta espansione dell'aneurisma con conseguente rischio di rottura aortica nonostante l'avvenuta correzione. L'endoleak rappresenta attualmente il punto debole delle procedure endovascolari addominali. La sua incidenza è molto variabile nelle casistiche pubblicate (0-44%). La persistenza di flusso può essere generata da una incompleta adesione dell'endoprotesi alla parete aortica (endoleak di 1° tipo), può derivare dalla vascolarizzazione aortica stessa, come per esempio da una arteria lombare o dalla mesenterica inferiore che va a rifornire per via retrograda l'aneurisma escluso dalla protesi (endoleak di 2° tipo) o essere dovuto a danneggiamenti della protesi stessa o porosità (endoleak di 3° e 4° tipo). Gli endoleak possono anche insorgere tardivamente (endoleak secondari), verosimilmente in rapporto ad cedimento della parete aortica su cui si esplica la forza radiale della protesi (e in particolare della sua struttura metallica) o alla mobilizzazione della protesi stessa
L'endotension è invece una pressurizzazione persistente o recidivante della sacca aneurismatica dopo correzione endoprotesica. E' quindi classificabile in base al flusso residuo nella sacca ed alla pressione da esso generata. Si verifica quindi endotension ad alta pressione ed alto flusso negli endoleak di tipo 1°, endotension ad alta pressione ma basso flusso negli endoleak di tipo 2° ma può anche verificarsi, con meccanismi ancora in fase di discussione, una subdola endotension a bassa pressione e basso flusso per la persistenza di una pressurizzazione sulla sacca apparentemente ben sigillata ed esclusa attraverso una trasmissione dell'onda sfigmica. Questi fenomeni richiedono pertanto un accurato e periodico follow-up per monitorare possibili evoluzioni dell'aneurisma nel post-operatorio.
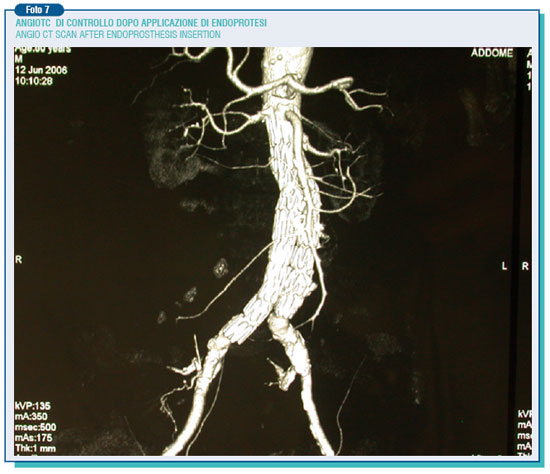
Infatti, mentre nel follow-up dell'intervento chirurgico tradizionale è buona norma praticare ogni anno per 4 - 5 anni un ecocolorDoppler dell'aorta addominale, nelle endoprotesi è necessario far eseguire ogni anno una angioTAC per tutta la vita del paziente. In ogni caso l'evidenza di un accrescimento dell'aneurisma residuo deve mettere in allarme gli operatori obbligando il paziente all'esecuzione di accurate indagini per identificare e trattare le possibili cause del fenomeno. Una terza via per la terapia degli AAA è la chirurgia aortica miniinvasiva che può consistere in una minilaparotomia o avvalersi della videolaparoscopia.
La chirurgia minilaparotomica in genere aggredisce gli aneurismi per via retroperitoneale attraverso un'incisione trasversale sottocostale sinistra di circa 5 cm, oppure un'incisione mediana longitudinale della stessa lunghezza.
Questa chirurgia comporta una riduzione dell'invasività e della degenza post-operatoria, con buoni risultati a medio termine.
Meno usata è la via transperitoneale con incisione longitudinale o trasversale mediana sopra-ombelicale di 10 - 12 cm., oppure un'incisione lombotomica obliqua sinistra di 8 - 12 cm. Per eseguire però questi interventi è necessario avere uno strumentario chirurgico particolare e soprattutto che il chirurgo si familiarizzi con un campo operatorio molto limitato. E' tutto il contrario di quello che si sosteneva un tempo: grande incisione, grande chirurgo.
Un training ancora maggiore richiede la chirurgia videolaparoscopica aortica attraverso sei piccoli fori praticati nell'addome per l'introduzione della videocamera e dei vari strumenti per forbici e portaaghi, pinze, aspiratore, clamps prossimale e distale.

Anche se il 1° intervento è stato praticato da Dion nel 1993, è una tecnica ancora poco diffusa perché i tempi chirurgici sono lunghi e può essere eseguita solo in casi selezionati: assenza di calcificazioni e di anomalie anatomiche, individui non obesi etc.
La via di accesso è in genere transperitoneale retrocolica. L'utilità della laparoscopia negli AAA non è ancora chiara, perché la riparazione è difficile non solo per la sutura, ma anche per l'esposizione, la dissezione, l'emostasi con clip delle arterie lombari che originano dall'aneurisma.
L'associazione alla videolaparoscopia di una minilaparotomia facilita, velocizza e rende più sicuro tutto l'intervento (laparoscopy hand assisted).
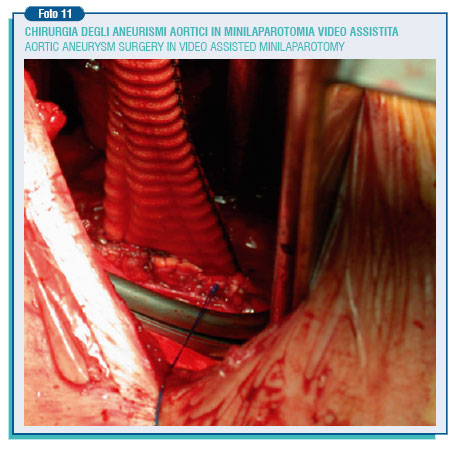
La via di accesso generalmente è la via transperitoneale con minilaparotomia di 6 - 8 cm. sopra-ombelicale e con introduzione nell'addome della mano non dominante del chirurgo.
Si può pure praticare la via retroperitoneale con minilaparotomia di 4 cm. tra l'ala iliaca anteriore superiore e la 12^ costa oppure sottocostale sinistra.
Questa terza via, assieme a quella endovascolare, corrisponde quindi all'evoluzione della chirurgia vascolare in senso mini-invasivo in attesa di possibili contributi futuri provenienti dalla chirurgia robotica, ma esse non devono porsi in alternativa alla chirurgia tradizionale, i cui risultati continuano a rappresentare il termine di confronto. Desidero terminare, per sottolineare ancora la necessità dell'intervento, con ciò che disse Crawford nel 1982: "Il primo fattore di rischio nell'aneurisma è la presenza dell'aneurisma stesso. Controllare periodicamente l'evoluzione significa generalmente solo osservarne l'espansione; oltre i 5 cm. significa aspettare la sua rottura".
Prof. Giorgio Agrifoglio
Chair of Vascular Surgery
Università degli studi di Milano
Bibliografia
1. Agrifoglio G., Gabrielli L., Chirurgia degli aneurismi dell'aorta e dei suoi rami. CIC, Roma, 1989
2. Alimi YS, Hartung O, Valerio N, Juhan C. Laparoscopic aortoiliac surgery for aneurysm and occlusive disease: when should a minilaparotomy be performed?. J Vasc Surg. 33: 469, 2001.
3. Anderson PL, Arons RR, Moskowitz AJ, Gelijns A, Magnell C, Faries PL, Clair D, Nowygrod R, Kent KC. A statewide experience with endovascular abdominal aortic aneurysm repair: rapid diffusion with excellent early results. J Vasc Surg. 39: 10, 2004.
4. Bergan J.J., Yao J.S.T.: Aneurysms: diagnosis and treatment. Grune & Stratton, New York, 1982.
5. Carpenter JP, for the Endologix Investigators. Multicenter trial of the PowerLink bifurcated system for endovascular aortic aneurysm repair. J. Vasc. Surg. 36: 1129, 2002.
6. Castronuovo JJ Jr, James KV, Resnikoff M, McLean ER, Edoga JK. Laparoscopic-assisted abdominal aortic aneurysmectomy. J Vasc Surg. 32: 224, 2000.
7. Creech O. Jr:
Endoaneurysmorraphy and treatment of aortic aneurysms. Ann Surg. 164: 935, 1966.
8. Dion YM, Gracia CR, Ben El Kadi H H. Totally laparoscopic abdominal aortic aneurysm repair. J Vasc Surg. 33: 181, 2001.
9. Dubost C, Allary M, Oeconomos N.: Resection of an aneurysm of the abdominal aorta: reestablishment of the continuity by a preserved human arterial graft, with result after five months. Arch Surg. 64:405, 1952.
10. Lederle FA, Johnson GR, Wilson SE et Al. for the Veterans Affairs Cooperative Study #417 Investigators Rupture Rate of Large Abdominal Aortic Aneurysms in Patients Refusing or Unfit for Elective Repair. JAMA. 287: 2968, 2002.
11. Lifeline Registry of EVAR Publications Committee Lifeline registry of endovascular aneurysm repair: long-term primary outcome measures. J Vasc Surg. 42: 1, 2005.
12. Matsumura JS, Brewster DC, Makaroun MS, Naftel DC. A multicenter controlled clinical trial of open versus endovascular treatment of abdominal aortic aneurysm. J Vasc Surg. 37: 262, 2003.
13. Moore WS, Matsumura JS, Makaroun MS, et al; EVT/Guidant Investigators: Five-year interim comparison of the Guidant bifurcated endograft with open repair of abdominal aortic aneurysm. J Vasc Surg 38: 46, 2003
14. Parodi J.C., Barone A.P., Schonholz C. Endovascular Treatment of Abdominal Aortic Aneurysms: Lessons Learned. J. Endovasc. Surg. 4: 102, 1997.
15. Sicard GA, Zwolak RM, Sidawy AN, White RA, Siami FS: Endovascular abdominal aortic aneurysm repair: Long-term outcome measures in patients at high-risk for open surgery. J.Vasc. Surg. 44: 229, 2006.




