da Leadership Medica n. 254 (2007)
Abstract
L'imaging cellulare e molecolare in risonanza magnetica (imaging-RM) sta avendo un grande sviluppo grazie all'altissima risoluzione spaziale e di contrasto raggiunta da questa metodica, ma anche per il notevole fermento nell'ambito della ricerca di nuovi mezzi di contrasto degli ultimi anni. Già con i mezzi di contrasto attualmente disponibili è possibile marcare determinate cellule ed ottenere la visualizzazione del loro percorso all'interno di un organismo vivente. Tuttavia, certamente l'obiettivo futuro più eccitante consiste nel creare mezzi di contrasto selettivi che siano in grado di rilevare specifiche molecole di interesse nell'ambito di un determinato tessuto. In questo manoscritto, dopo una parte introduttiva, verranno brevemente illustrati due esempi di imaging cellulare in RM (Risonanza Magnetica), che sono attualmente possibili e rappresentano due diversi filoni di ricerca in sviluppo presso il nostro Istituto. Nell'ultima parte l'attenzione verrà focalizzata sulla spettroscopia a risonanza magnetica che rappresenta a tutti gli effetti una metodica di imaging molecolare.
In particolare verrà illustrata la possibilità di studiare il metabolismo energetico cardiaco non invasivamente mediante spettroscopia del fosforo (31P), essendo questa una tra le principali applicazioni extracraniche della spettroscopia a risonanza magnetica.

Note introduttive
L'imaging con Risonanza Magnetica (RM) si sta ritagliando un importante ruolo nel campo dell'imaging cellulare e molecolare.
I notevoli sviluppi nella ricerca dei mezzi di contrasto, l'introduzione di magneti ad alto campo e di micro-bobine che consentono di raggiungere una risoluzione microscopica e la sempre maggiore consapevolezza delle potenzialità della spettroscopia-RM e dell'imaging spettroscopico, conferiscono alla RM la possibilità di studiare in vivo gli eventi biologici a livello cellulare e subcellulare. Il passaggio da un imaging d'organo di tipo anatomico ad un imaging cellulare o addirittura molecolare è indispensabile nell'era in cui l'uso delle cellule staminali consente la ricostituzione di tessuti funzionalmente validi, la terapia genica rappresenta oramai una realtà per alcune applicazioni (e una promessa per molte altre) e le terapie cellulari sono proposte in molti campi della medicina compresa l'oncologia. Fondamentale è avere a disposizione una metodica d'imaging cellulare efficiente da impiegare, per esempio, nel campo della medicina rigenerativa basata sull'uso delle cellule staminali, per poter seguire in vivo la migrazione, la localizzazione e il destino delle cellule iniettate e per poter confrontare in vivo l'efficacia di diversi sottotipi cellulari e differenti modulazioni farmacologiche.
In tale ambito, peraltro, la RM riveste un ruolo privilegiato proprio grazie alle sue caratteristiche intrinseche. Essa infatti consente un imaging non invasivo, e in assenza di radiazioni ionizzanti, tridimensionale ad alta risoluzione spaziale e di contrasto, permette di visualizzare e seguire anche quantità molto piccole di cellule ed inoltre offre il grande vantaggio di poter trasportare gli esperimenti dall'animale all'uomo senza significative variazioni metodologiche.
Imaging cellulare RM e immunoterapia dei tumori
Un emergente campo di applicazione dell'imaging cellulare con RM è l'immunoterapia dei tumori mediante vaccini a base di cellule dendritiche (DCs). Per la messa a punto di tali terapie è di estrema importanza avere a disposizione dati attendibili sulla migrazione delle cellule in vivo.
Nel nostro Istituto (in collaborazione con l'Unità di Ricerca - Prof. A. Manfredi) abbiamo sviluppato una tecnica per marcare le DCs con nanoparticelle di ossido di ferro (SPIO) ed è stata sperimentata la possibilità di monitorare i movimenti di tali cellule in vivo, nel topo, dopo iniezione delle stesse endovena. La marcatura di DCs murine, derivate dal midollo osseo di topi C57BL/6, è stata realizzata utilizzando un mezzo di contrasto approvato per l'uso clinico a base di nanoparticelle superparamagnetiche di ossido di ferro (SPIO). Le cellule dendritiche sono state incubate con SPIO per 16 ore in modo da ottenere un sufficiente uptake di mezzo di contrasto. Allo scopo di testare la minima quantità di contrasto necessaria per ottenere una buona marcatura, diversi campioni composti da 2 milioni di DCs sono stati incubati ciascuno con una diversa concentrazione di SPIO (0, 80, 160, 320, 640 g/ml) e successivamente sottoposti ad imaging RM in vitro. Il rapporto segnale/rumore (S/N) è stato misurato per ognuno di tali campioni e sulla base di questi dati è stata scelta la concentrazione di SPIO da utilizzare per marcare le DCs destinate agli esperimenti in vivo.
Successivamente le cellule dendritiche marcate con SPIO (SPIO-DCs) sono state iniettate endovena in 4 topi singenici portatori di linfoma impiantato in sede sottocutanea. Questi topi sono stati sottoposti ad imaging RM in vivo durante anestesia generale. L'imaging RM è stato ripetuto 4 volte in ogni topo: è stato eseguito uno studio basale prima dell'iniezione delle SPIO-DCs e tre studi dopo l'iniezione delle stesse, rispettivamente a 1 ora, 24 ore e 48 ore. Il rapporto S/N del fegato, della milza e del tumore è stato misurato per ciascuno di tali studi e l'analisi istologica degli organi ha rappresentato il gold standard per verificare la migrazione delle SPIO-DCs all'interno dei tessuti. Negli esperimenti in vitro il rapporto S/N osservato si è dimostrato progressivamente più basso passando dalle cellule incubate con 0 mg/ml di SPIO alle cellule marcate utilizzando una concentrazione di 320 mg/ml, mentre non è stata osservata significativa differenza fra le cellule incubate con 320 mg/ml e quelle incubate con 640 mg/ml di SPIO.
L'uptake di SPIO alle concentrazioni da noi utilizzate non si è dimostrato tossico per le DCs e non ha compromesso la loro capacità di presentare l'antigene alle cellule T e di attivare le cellule T stesse; quest'ultima è stata testata in vitro usando proteine esogene (OVA). Negli studi effettuati in vivo, si è osservata, dopo iniezione in vena delle SPIO-DCs, una significativa riduzione del rapporto segnale rumore del fegato e della milza.
Il rapporto S/N del tumore, invece, non è variato significativamente prima e dopo l'iniezione endovena delle SPIO-DCs. I risultati dell'imaging RM si sono rivelati in accordo con la valutazione istologica che ha confermato la presenza delle SPIO-DCs iniettate per via endovenosa nel fegato e nella milza dei topi esaminati e la loro assenza all'interno del tumore.
Questo esperimento dimostra che le DCs possono essere facilmente marcate con SPIO, in quanto lo internalizzano senza subire danni e senza modificare le proprie specifiche capacità cellulari e, inoltre, una volta marcate, la loro migrazione in vivo può essere monitorata mediante imaging RM.
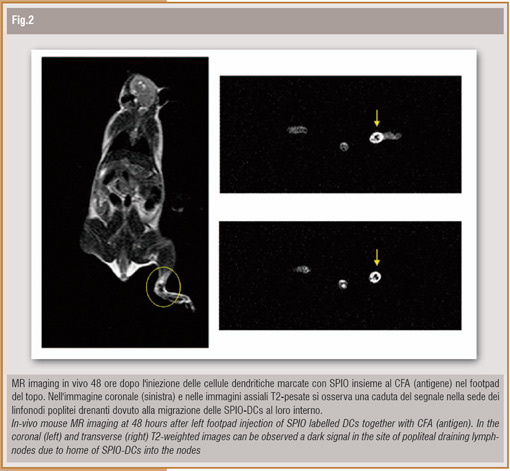
Peraltro, il successo dell'immunoterapia dei tumori con DCs dipende strettamente dall'interazione di tali cellule con le cellule T antigene specifiche che da questa interazione vengono attivate e, per massimizzare questa interazione, è essenziale la migrazione delle cellule dendritiche nei linfonodi dell'ospite. Pertanto, in un esperimento successivo, abbiamo voluto verificare la possibilità di visualizzare tale migrazione in vivo. Dopo iniezione subcutanea di SPIO-DCs e antigene nel footpad di un topo si è osservata una chiara riduzione di segnale nella sede del linfonodo drenante; l'analisi istologica dello stesso ha confermato la presenza delle SPIO-DCs al suo interno. Un esperimento molto simile a quello appena descritto è stato recentemente pubblicato da Baumjohann D et al.1 a dimostrazione che utilizzando un mezzo di contrasto clinicamente approvato è possibile visualizzare non-invasivamente la migrazione delle cellule dendritiche nel linfonodo drenante per mezzo dell'imaging RM.
Imaging cellulare RM e trapianto di isole pancreatiche
Lo stesso tipo di approccio utilizzato per marcare le cellule dendritiche è stato impiegato anche nel tentativo di marcare le isole pancreatiche di Langerhans. Il trapianto di isole pancreatiche rappresenta una promettente alternativa alla somministrazione di insulina nella cura del diabete mellito di tipo 1 (T1DM). Questo tipo di trattamento, disponibile solo per una minoranza di pazienti a causa della limitata disponibilità di organi da cadavere, consente di ristabilire la produzione endogena di insulina con il recupero dell'insulino-indipendenza in oltre l'80% dei casi.
Inoltre, indipendentemente dal recupero dell'insulino-indipendenza, ulteriori vantaggi osservati in pazienti trapiantati di isole sono un miglior controllo dell'emoglobina glicata HbA1c, una riduzione degli eventi di ipoglicemia e una riduzione delle complicanze diabetiche.2 Uno dei problemi principali di questo tipo di trattamento è che il successo a lungo termine del trapianto non è sempre garantito.
Si conosce molto poco del destino delle isole all'interno del fegato umano, dopo che sono state trapiantate mediante infusione nella vena porta. Per questi motivi è di estrema importanza sviluppare una metodica d'imaging affidabile e non-invasiva che consenta di seguire nel tempo il destino del trapianto e di studiare le relazioni fra la massa delle isole trapiantate e fattori come l'insulino-indipendenza, la funzione del graft e lo sviluppo delle complicanze diabetiche.
Una simile metodica d'imaging sarebbe inoltre di grande utilità nella valutazione degli effetti di differenti strategie di immunomodulazione sulla preservazione della massa delle isole o viceversa sulla loro riduzione a causa del rigetto.
Recentemente, in molti centri è stata investigata la possibilità di marcare le isole pancreatiche utilizzando nanoparticelle superparamagnetiche (SPIO) e di visualizzarle in vivo mediante imaging RM, con risultati molto promettenti.2
Nel nostro Istituto (in collaborazione con l'Unità di Ricerca - Dr. E. Bonifacio/Dr.ssa M.L. Malosio) abbiamo marcato isole pancreatiche sia murine che umane utilizzando nanoparticelle di ossido di ferro approvate per l'uso clinico.
La vitalità delle isole e la loro capacità di secernere insulina sono state testate in vitro; esse si sono rivelate immutate dopo la marcatura. Le isole marcate sono state sottoposte ad imaging RM sia in-vitro che in-vivo. Gli esperimenti sono ancora in una fase preliminare, tuttavia l'imaging in-vitro ha dimostrato una buona correlazione fra la perdita di segnale ed il numero di isole esaminate. Nei primi studi di imaging in-vivo da noi effettuati è stato possibile identificare le isole marcate trapiantate in sede sub-capsulare renale in alcuni topi che erano stati resi diabetici e che avevano recuperato la normoglicemia dopo il trapianto. Gli obiettivi futuri di questo filone di ricerca consistono nel definire meglio il comportamento delle isole marcate con SPIO dopo il trapianto in modelli animali di diabete, fino ad ottenere dati sufficienti per trasferire lo sviluppo di tale metodologia nell'uomo.
Spettroscopia RM e la misura delle molecole
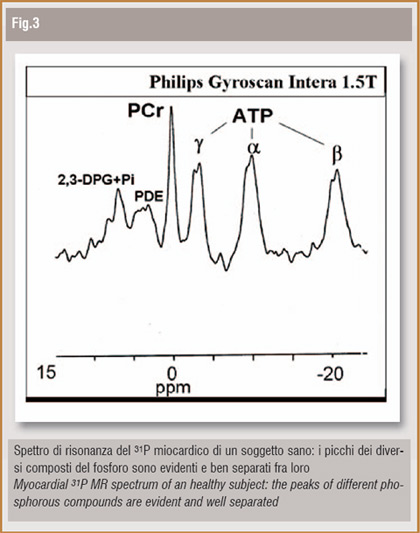
Come già accennato, le peculiarità della RM consentono non solo di raggiungere il livello cellulare ma addirittura di spingersi verso un vero e proprio imaging molecolare. L'esempio più evidente, che dimostra come la RM possa consentire una vera è propria analisi molecolare dei tessuti, è la spettroscopia-RM (MRS). La MRS, essendo basata come l'imaging RM sul fenomeno di risonanza magnetica nucleare, è una tecnica totalmente non invasiva e sicura, applicabile per studi in vivo sia nell'uomo che nell'animale da esperimento. Ogni nucleo con momento magnetico diverso da zero, immerso in un campo magnetico statico ed eccitato con impulso-RF, emette un segnale con lunghezza d'onda caratteristica; se il nucleo fa parte di una molecola, il segnale di risonanza emesso avrà lunghezza d'onda lievemente diversa a seconda della struttura della molecola stessa. Questo fenomeno, definito "chemical shift", consente un'analisi qualitativa e quantitativa della composizione molecolare dei tessuti. I nuclei di maggiore interesse clinico sono fosforo (31P), idrogeno (1H) e carbonio (13C). Attualmente l'applicazione body più stimolante è la Spettroscopia-RM cardiaca del 31P (31P-MRS).
Il 31P è un componente fondamentale delle molecole chiave del metabolismo energetico miocardico e il rapporto fosfocreatina PCr/ATP si è dimostrato il parametro più riproducibile e utile per misurare lo stato di benessere di tale metabolismo.
Nel nostro Istituto abbiamo affiancato la 31P-MRS alla cardio-RM per studiare atleti professionisti, pazienti con cardiomiopatia ipertrofica (HCM), pazienti con diabete mellito di tipo 1 e uremia (T1DM-Ur)3 e pazienti con scompenso cardiaco cronico (CHF)4. Tutti gli studi sono stati realizzati con magnete a 1.5T (Philips).
I risultati hanno evidenziato l'assoluta normalità del metabolismo energetico nel cuore con ipertrofia benigna degli atleti, indipendentemente dal tipo d'allenamento svolto; per contro l'alterazione dello stesso metabolismo nell'ipertrofia maligna dei soggetti con HCM. Nei pazienti con T1DM-Ur si è osservato che l'alterazione metabolica anticipa l'alterazione funzionale del cuore e che la correzione del diabete e dell'uremia con trapianto di rene-pancreas normalizza il metabolismo cardiaco.
Nei soggetti con CHF il rapporto PCr/ATP si è dimostrato alterato in relazione con i sintomi e con la capacità di lavoro del cuore. L'esperienza personale maturata, così come gli studi della letteratura, ci consente di concludere che la spettroscopia fornisce informazioni esclusive, complementari a quelle dell'imaging, che sembrano utili nella diagnosi precoce di alcune patologie miocardiche, nel monitoraggio degli effetti delle terapie e nella comprensione fisiopatologica delle malattie del cuore.
Prof. Alessandro del Maschio
Full Professor and Chairman of Radiology
Università Vita-Salute S. Raffaele - Milano, Italy
Bibliografia
1. Baumjohann D, Hess A, Budinsky L, Brune K, Schuler G, Lutz MB.
In vivo magnetic resonance imaging of dendritic cell migration into the draining lymph nodes of mice. Eur J Immunol. 2006 Sep;36(9):2544-55.
2. Evgenov NV, Medarova Z, Dai G, Bonner-Weir S, Moore A.
In vivo imaging of islet transplantation. Nat Med 2006 Jan;12(1):144-8.
3. Perseghin G, Fiorina P, De Cobelli F, Scifo P, Esposito A, Canu T, Danna M, Gremizzi C, Secchi A, Luzi L, Del Maschio A. Cross-sectional assessment of the effect of kidney and kidney-pancreas transplantation on resting left ventricular energy metabolism in type 1 diabetic-uremic patients: a phosphorous-31 magnetic resonance spectroscopy study. J Am Coll Cardiol. 2005 Sep 20;46(6):1085-92.
4. Fragasso G, Perseghin G, De Cobelli F, Esposito A, Palloshi A, Lattuada G, Scifo P, Calori G, Del Maschio A, Margonato A. Effects of metabolic modulation by trimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure. Eur Heart J. 2006 Apr;27(8):942-8. Epub 2006 Mar 1.




